Πώς αλληλεπιδρούν πολικά και μη μόρια μεταξύ τους
Τόσο πολικά όσο και μη πολικά μόρια βρίσκονται σε ομοιοπολικές ουσίες. Ορισμένα ομοιοπολικά μόρια έχουν την ικανότητα να πολώνονται και μερικά όχι. Τα πολικά μόρια και τα μη πολικά μόρια αλληλεπιδρούν μεταξύ τους με διαφορετικούς τρόπους. Τα πολικά μόρια αλληλεπιδρούν μεταξύ τους με δυνάμεις όπως οι αλληλεπιδράσεις διπόλου-διπόλου, ενώ τα μη πολικά μόρια αλληλεπιδρούν μεταξύ τους μέσω των δυνάμεων διασποράς του Λονδίνου. Ας ρίξουμε μια ματιά στο πώς αυτά τα μόρια διαφέρουν μεταξύ τους στη φύση και πώς αλληλεπιδρούν μεταξύ τους.
Αυτό το άρθρο εξηγεί,
1. Τι είναι τα πολικά μόρια;
– Ορισμός, χαρακτηριστικά και παραδείγματα
2. Τι είναι τα μη πολικά μόρια;
– Ορισμός, χαρακτηριστικά και παραδείγματα
3. Πώς αλληλεπιδρούν πολικά και μη μόρια μεταξύ τους;
Τι είναι τα πολικά μόρια
Τα πολικά μόρια είναι αποτέλεσμα ασύμμετρων διασκορπισμένων ηλεκτρονίων σε ένα μόριο. Ένας ομοιοπολικός δεσμός σχηματίζεται με την κοινή χρήση δύο ηλεκτρονίων μεταξύ δύο ατόμων. Αυτά τα άτομα μπορεί να είναι του ίδιου στοιχείου ή δύο διαφορετικών στοιχείων. Όταν εμπλέκονται δύο διαφορετικά στοιχεία, μπορεί να έχουν παρόμοιες ηλεκτραρνητικότητα (την ικανότητα να προσελκύουν ηλεκτρόνια) ή διαφορετικές ηλεκτραρνητικότητες. Εάν η διαφορά ηλεκτραρνητικότητας μεταξύ δύο ατόμων είναι 0,4<, υπάρχει μεγάλη τάση για το πιο ηλεκτραρνητικό άτομο να τραβήξει το κοινό ζεύγος ηλεκτρονίων προς το μέρος του. Ως εκ τούτου, θα επάγεται ένα ελαφρύ αρνητικό φορτίο (δ-), αφήνοντας το άλλο άτομο ελαφρώς θετικό (δ+). Αυτή η διαδικασία ονομάζεται πόλωση .
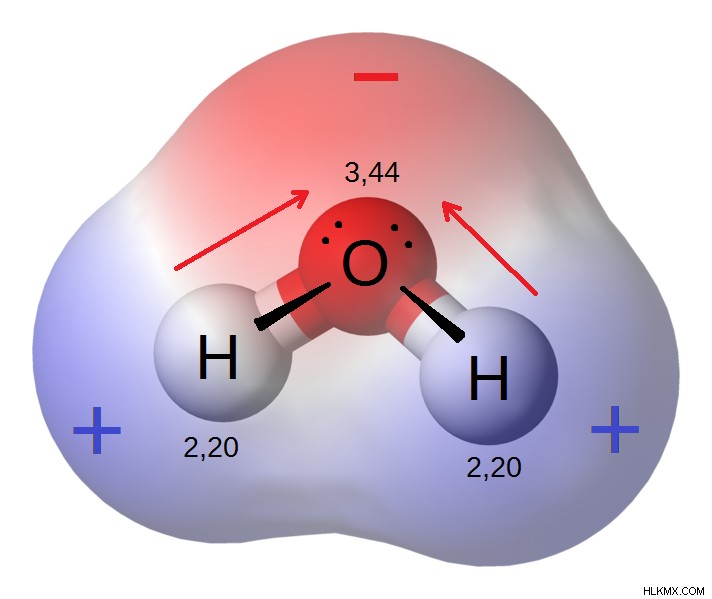
Εικόνα 1:Μόνιμο δίπολο μορίου νερού
Το μόριο του νερού είναι ένα καλό παράδειγμα πολικών μορίων. Η διαφορά ηλεκτραρνητικότητας μεταξύ Ο και Η είναι 1,5. Ως εκ τούτου, το ζεύγος των κοινών ηλεκτρονίων έλκεται περισσότερο προς το άτομο οξυγόνου που είναι πιο ηλεκτραρνητικό. Επομένως, το μόριο του νερού λέγεται ότι είναι πολωμένο.
Μερικά άλλα παραδείγματα πολικών μορίων είναι η αμμωνία (NH3 ), Υδρόθειο (H2 S) και διοξείδιο του θείου (SO2 ).
Τι είναι τα μη πολικά μόρια
Τα μη πολικά μόρια έχουν συμμετρικά κατανεμημένα ηλεκτρόνια. Ως εκ τούτου, δεν υπάρχει διαχωρισμός τελών. Βασικά, αυτό συμβαίνει όταν δύο άτομα παρόμοιας ηλεκτραρνητικότητας ενώνονται για να δημιουργήσουν έναν ομοιοπολικό δεσμό. Ως εκ τούτου, το ζεύγος ηλεκτρονίων που μοιράζονται δεν είναι σχεδόν προκατειλημμένο προς κανένα από τα συμμετέχοντα άτομα. Δεν μπορεί να παρατηρηθεί διαχωρισμός φορτίου σε τέτοια μόρια. Ωστόσο, ακόμη και αν υπάρχει διαχωρισμός φορτίου, το σχήμα ορισμένων μορίων ακυρώνει τα φορτία. CO2 είναι χαρακτηριστικό παράδειγμα.

Εικόνα 2:Δομή διοξειδίου του άνθρακα Lewis
Ακόμη και αν υπάρχει επαρκής διαφορά ηλεκτραρνητικότητας μεταξύ των ατόμων C και O ώστε να πληρούν τις προϋποθέσεις για έναν πολικό δεσμό, τα φορτία ακυρώνονται λόγω του γραμμικού σχήματος του μορίου με αποτέλεσμα ένα καθαρό δίπολο του μηδενός. Ως εκ τούτου, το μόριο διοξειδίου του άνθρακα θεωρείται ως μη πολικό μόριο.
Παραδείγματα μη πολικών ενώσεων είναι κυρίως μόρια διατομικών αερίων όπως το N2 , Cl2 και O2 . Τα υγρά υδρογονανθράκων είναι επίσης μη πολικά τις περισσότερες φορές. Τολουόλιο, βενζίνη, πεντάνιο και εξάνιο είναι μερικά παραδείγματα.
Πώς αλληλεπιδρούν τα πολικά και τα μη πολικά μόρια μεταξύ τους
Οι δύο τύποι μορίων αλληλεπιδρούν μεταξύ τους διαφορετικά.
Πώς αλληλεπιδρούν τα πολικά μόρια μεταξύ τους

Εικόνα 3:Αλληλεπίδραση διπόλου-διπόλου μεταξύ δύο μορίων HCl
Τα πολικά μόρια αλληλεπιδρούν μεταξύ τους με δυνάμεις όπως οι αλληλεπιδράσεις διπόλων-διπόλων. Συζητήθηκε νωρίτερα ότι τα πολικά μόρια έχουν άνιση κατανομή φορτίου λόγω ασύμμετρης διασποράς ηλεκτρονίων. Επομένως, το ελαφρώς θετικό άκρο ενός πολικού μορίου έλκεται προς το ελαφρώς αρνητικό άκρο ενός άλλου μορίου. Το παραπάνω σχήμα (3) δείχνει καθαρά την αλληλεπίδραση.
Το ελαφρώς θετικό άτομο H ενός μορίου έλκεται προς το ελαφρώς αρνητικό άτομο Cl του δεύτερου μορίου. Η δύναμη έλξης μεταξύ των δύο μορίων είναι γνωστή ως αλληλεπίδραση διπόλου-διπόλου.
Υπάρχει ένα ειδικό είδος αλληλεπίδρασης διπόλου-διπόλου που ονομάζεται δεσμός υδρογόνου . Αυτή η αλληλεπίδραση περιλαμβάνει έναν δότη υδρογόνου, ο οποίος είναι ένα εξαιρετικά ηλεκτραρνητικό άτομο ενός μορίου που δίνει το υδρογόνο του για να σχηματίσει έναν δεσμό με ένα άλλο άκρως ηλεκτραρνητικό άτομο με ένα μόνο ζεύγος ηλεκτρονίων, από ένα άλλο μόριο. Ο τελευταίος ονομάζεται αποδέκτης υδρογόνου. Το παρακάτω σχήμα (4) απεικονίζει τους δεσμούς υδρογόνου στο νερό.
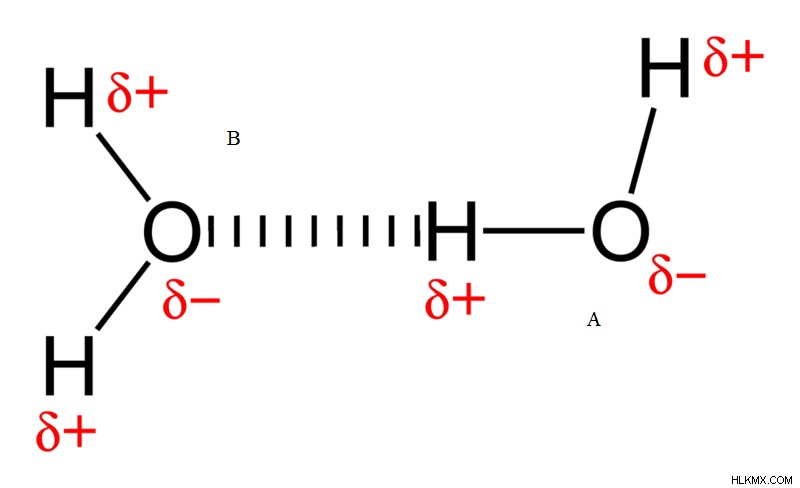
Εικόνα 4:Δεσμοί υδρογόνου στο νερό
Το άτομο οξυγόνου με την ένδειξη B δέχεται υδρογόνο από το άτομο οξυγόνου Α και δημιουργεί δεσμό μεταξύ των δύο μορίων νερού. Το άτομο οξυγόνου Α είναι ο δότης υδρογόνου ενώ το άτομο οξυγόνου Β είναι ο δέκτης υδρογόνου.
Πώς αλληλεπιδρούν τα μη πολικά μόρια μεταξύ τους
Τα μη πολικά μόρια δεν μπορούν να σχηματίσουν αλληλεπιδράσεις διπόλων-διπόλων. Αντίθετα, αλληλεπιδρούν μεταξύ τους σχηματίζοντας δυνάμεις διασποράς του Λονδίνου.
Τα ηλεκτρόνια ενός μορίου κινούνται τυχαία. Όταν τα ηλεκτρόνια συλλέγονται προς το ένα άκρο του μη πολικού μορίου, προκαλείται ένα ελαφρύ αρνητικό φορτίο στο συγκεκριμένο άκρο. Κάνει το άλλο άκρο του μορίου ελαφρώς θετικό. Αυτό οδηγεί σε έναν προσωρινό διαχωρισμό φορτίου στο μόριο. Όταν ένα άλλο μη πολικό μόριο έρχεται στη γειτονιά, το πρώτο μόριο έχει την ικανότητα να επάγει ένα δίπολο και στο δεύτερο. Αυτό συμβαίνει λόγω της απόκρουσης παρόμοιων φορτίων. 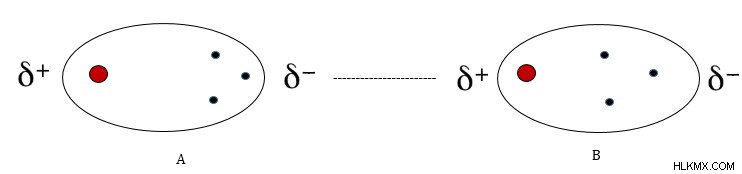
Η πυκνότητα ηλεκτρονίων του αρνητικού άκρου του μορίου Α, απωθεί τα ηλεκτρόνια του διπλανού άκρου του μορίου Β, προκαλώντας θετικό φορτίο σε αυτό το άκρο. Στη συνέχεια σχηματίζεται ένας αδύναμος δεσμός στα δύο άκρα.
Αλληλεπίδραση μεταξύ πολικών και μη πολικών μορίων
Οι διασπορές του Λονδίνου ονομάζονται πολύ πιο αδύναμες από τις δυνάμεις διπόλου-διπόλου των πολικών μορίων. Επομένως, η τάση πολικών μορίων να αλληλεπιδρούν με μη πολικά μόρια είναι ελάχιστη. Επειδή η ενέργεια που απελευθερώνεται από το σχηματισμό δυνάμεων διασποράς μεταξύ πολικών και μη πολικών μορίων δεν είναι αρκετή για να σπάσει ισχυρές αλληλεπιδράσεις διπόλου-διπόλου μεταξύ πολικών μορίων. Επομένως οι μη πολικές διαλυμένες ουσίες δεν μπορούν να διαλυθούν σε πολικούς διαλύτες.
Κούρτους, Ρον. «Πολικά και μη πολικά μόρια». Κατανόηση της Χημείας:Σχολείο για Πρωταθλητές . Ν.π., ν.δ. Ιστός. 07 Φεβ. 2017. "Γιατί οι πολικές και οι μη πολικές ενώσεις δεν διαλύονται η μία την άλλη;" Chemistry Stack Exchange . Ν.π., ν.δ. Ιστός. 07 Φεβρουαρίου 2017.