Διαφορά μεταξύ διαλύματος και αναστολής
Κύρια διαφορά – Λύση έναντι αναστολής
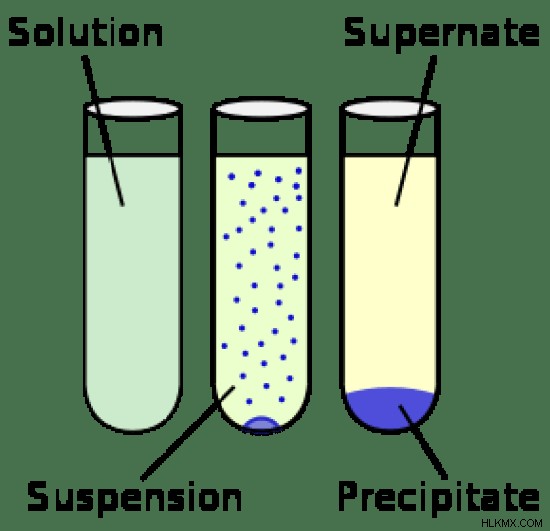
Οι λύσεις και οι αναστολές θεωρούνται και τα δύο ως μείγματα. Η βασική διαφορά μεταξύ διαλύματος και εναιωρήματος είναι το μέγεθος των σωματιδίων τους. Τα σωματίδια σε ένα διάλυμα είναι πολύ μικρότερα από αυτά των εναιωρημάτων. Λόγω αυτής της διαφοράς μεταξύ σωματιδίων διαλυμένης ουσίας και σωματιδίων εναιωρήματος, υπάρχουν διακριτές διαφορές στα δύο συστήματα. Ωστόσο, τα συστατικά και των δύο συστημάτων δεν είναι χημικά συνδεδεμένα μεταξύ τους και μπορούν να διαχωριστούν με βάση τις φυσικές τους ιδιότητες όπως το μέγεθος, η διαλυτότητα και η πυκνότητα.
Αυτό το άρθρο εξηγεί,
1. Τι είναι η Λύση;
– Ορισμός, Χαρακτηριστικά, Παραδείγματα
2. Τι είναι η αναστολή;
– Ορισμός, Χαρακτηριστικά, Παραδείγματα
3. Ποια είναι η διαφορά μεταξύ Solution και Suspension; 
Τι είναι μια λύση – Ορισμός, Χαρακτηριστικά, Παραδείγματα
Ένα διάλυμα είναι ένα ομοιογενές μείγμα δύο ουσιών. Το πιο άφθονο συστατικό του συστήματος είναι γνωστό ως διαλύτης, ενώ η διαλυμένη ουσία είναι η ουσία που διαλύεται στο διάλυμα. Τα σωματίδια της διαλυμένης ουσίας βρίσκονται είτε σε ατομικό είτε σε μοριακό επίπεδο. Το μέγεθος των σωματιδίων της διαλυμένης ουσίας είναι συνήθως <1 nm. Οι διαλύτες και οι διαλυμένες ουσίες βρίσκονται στην ίδια φάση και δεν μπορούν να διακριθούν ακόμη και σε μικροσκόπιο φωτός. Η ομοιογένεια των διαλυμάτων προκύπτει από το γεγονός ότι οι διαλυμένες ουσίες είναι ομοιόμορφα κατανεμημένες στον διαλύτη. Τα συστατικά ενός συστήματος διαλύματος είναι συγκριτικά δύσκολο να διαχωριστούν από αυτά των εναιωρημάτων ή των κολλοειδών.
Π.χ.:Το NaCl είναι ένα λευκό στερεό. Μετά τη διάλυσή του στο νερό, δεν μπορείτε πλέον να δείτε το λευκό στερεό. Αντίθετα, θα δείτε μόνο τη διαφανή λύση.
Τα διαλύματα είναι διαφανή λόγω του μικρού μεγέθους των σωματιδίων της διαλυμένης ουσίας, τα οποία εμποδίζουν την ανάκλαση ή τη διασπορά του φωτός. Τα διαλύματα, σε μια δεδομένη θερμοκρασία, είναι σταθερά και παραμένουν ομοιογενή χωρίς να καθιζάνουν σωματίδια.
Ο σχηματισμός των διαλυμάτων εξαρτάται από τη συγγένεια των διαλυμένων ουσιών με τον διαλύτη. Οι πολικές διαλυμένες ουσίες διαλύονται μόνο σε πολικούς διαλύτες και οι μη πολικές διαλυμένες ουσίες διαλύονται μόνο σε μη πολικούς διαλύτες. Το νερό είναι ο πιο γνωστός πολικός διαλύτης. Οι πολικές διαλυμένες ουσίες όπως αλάτι, ζάχαρη, KCl διαλύονται εύκολα. Οι περισσότεροι οργανικοί διαλύτες όπως το βενζόλιο, το εξάνιο και ο πετρελαϊκός αιθέρας είναι μη πολικοί. Το ιώδιο και το φελιζόλ μπορούν να δοθούν ως παραδείγματα μη πολικών διαλυτών.
Μερικά παραδείγματα λύσεων μπορούν να δοθούν ως εξής:
Αέριο σε αέριο:αέρας
Αέριο σε υγρό:σόδα
Υγρό σε υγρό:νερό και αλκοόλ
Στερεό σε υγρό:NaCl στο νερό
Υγρό σε στερεά:αμάλγαμα υδραργύρου, υδράργυρος σε ασήμι
Στερεά σε στερεά:κράματα, χάλυβας, ορείχαλκος, μπρούτζος
Τι είναι η αναστολή – Ορισμός, Χαρακτηριστικά, Παραδείγματα
Τα σωματίδια των αιωρημάτων είναι συχνά μεγαλύτερα από 1000 nm. Επομένως, οι αναστολές είναι ετερογενείς. Δεν είναι μιας φάσης. Όταν το χώμα αναμιγνύεται με νερό, τα μεγάλα σωματίδια του εδάφους μπορούν να φαίνονται καθαρά και να διακρίνονται από το νερό. Αυτό το σύστημα είναι μια τυπική ανάρτηση. Τα σωματίδια σε ένα εναιώρημα τείνουν να ταξιδεύουν μέσω του μέσου και υφίστανται καθίζηση με το χρόνο. Λόγω των μεγάλων μεγεθών των σωματιδίων, μπορούν εύκολα να διαχωριστούν με διήθηση. Τα εναιωρήματα είναι θολά, σε αντίθεση με τα διαλύματα λόγω του μεγαλύτερου μεγέθους σωματιδίων. Το φως διασκορπίζεται ή ανακλάται από αυτά τα σωματίδια.
Τα περισσότερα γνωστά εναιωρήματα σχηματίζονται με την εναιώρηση στερεών σωματιδίων σε υγρά (π.χ.:λασπωμένο νερό, CaCO3 στο νερό). Ωστόσο, μπορεί να υπάρξουν περιστατικά αιωρημάτων υγρού-υγρού (υδράργυρος σε λάδι/νερό), εναιωρήματα στερεού-αερίου (αιθάλη στον αέρα). Τα γαλακτώματα είναι μια μορφή εναιωρημάτων όπου δύο μη αναμίξιμα υγρά ανακινούνται μεταξύ τους για να σχηματίσουν ένα θολό μείγμα. Όταν αυτό αφεθεί να σταθεί, φαίνεται εύκολα ο διαχωρισμός δύο υγρών στρωμάτων. Το λάδι και το νερό μαζί είναι ένα καλό παράδειγμα για τα γαλακτώματα.
Μερικά από του στόματος φάρμακα είναι διαθέσιμα ως εναιωρήματα. Για παράδειγμα, το γάλα μαγνησίας που χρησιμοποιείται για θεραπείες με αντιόξινα είναι ένα εναιώρημα υδροξειδίου του μαγνησίου.
Οι αναστολές δεν είναι μιας φάσης. Μπορεί να υπάρξει διαχωρισμός φάσης εάν το σύστημα αφεθεί σε ηρεμία για κάποιο χρονικό διάστημα. Ως εκ τούτου, αυτά δεν είναι σταθερά.

Διαφορά μεταξύ διαλύματος και αναστολής
Σύνθεση
Λύση: Τα διαλύματα είναι ομοιογενή (η σύνθεση είναι ίδια σε όλη την έκταση). Τα σωματίδια διαλυμένης ουσίας διαλύονται σε έναν διαλύτη και διασπείρονται ομοιόμορφα.
Αναστολή: Οι αναστολές είναι ετερογενείς. Τα σωματίδια μπορούν να διακριθούν ορατά και η διασπορά των σωματιδίων δεν είναι ομοιόμορφη.
Μέγεθος σωματιδίου
Λύση: Το μέγεθος των σωματιδίων είναι <1 nm. Είναι συγκριτικά πολύ μικρά και είτε ατομικού είτε μοριακού επιπέδου. Δεν μπορούν να φανούν ακόμη και κάτω από μικροσκόπιο φωτός.
Αναστολή: Το μέγεθος σωματιδίων είναι >1000 nm. Τα σωματίδια είναι συγκριτικά πολύ μεγάλα και φαίνονται με γυμνό μάτι. Μπορούν να υπάρχουν ως πήξεις.
Ιδιότητες
Λύση: Οι διαλυμένες ουσίες και ο διαλύτης βρίσκονται στην ίδια φάση.
Αναστολή: Τα αιωρούμενα σωματίδια μπορεί να βρίσκονται σε διαφορετική φάση από το μέσο.
Εμφάνιση
Λύση: Οι λύσεις είναι διαφανείς. Δεν υπάρχει σκέδαση φωτός.
Αναστολή: Οι αναρτήσεις είναι θολό. Το φως μπορεί να ανακλάται ή να διασκορπίζεται.
Παραδείγματα
Λύση: Παραδείγματα περιλαμβάνουν NaCl στο νερό και ζάχαρη στο νερό.
Αναστολή: Στα παραδείγματα περιλαμβάνεται γάλα μαγνησίας, αιθάλη στον αέρα.
Λίστα αναφοράς:
"Διαλυτότητα των πραγμάτων:Ένας ιστότοπος για τη χημεία." Διάλυμα, διαλύτης, ορισμός διαλύματος με παραδείγματα . Educating Online, n.d. Ιστός. 01 Φεβρουαρίου 2017. «Μείγματα, διαλύματα και εναιωρήματα». Η εργαλειοθήκη μηχανικής . Ν.π., ν.δ. Ιστός. 01 Φεβρουαρίου 2017. Rezabal, Elixabete και Thomas Schäfer. «Ιονικά υγρά ως διαλύτες πολικών και μη πολικών διαλυμένων ουσιών:συγγένεια και συντονισμός». Φυσική Χημεία Χημική Φυσική 17.22 (2015):14588-14597. "Colloidal Solution." Ενισχύθηκε . Ν.π., ν.δ. Ιστός. 01 Φεβ. 2017.«Αναστολή και κολλοειδή | Ιδιότητες αναστολής.» Χημεία . Byjus Classes, 08 Νοεμβρίου 2016. Web. 01 Φεβ. 2017.Shukla, Brajesh. «Τι είναι οι αναστολές και αναφέρετε τις ιδιότητές του;» PreserveArticles.com . Ν.π., ν.δ. Ιστός. 01 Φεβ. 2017.Volland, Walt. "Διαλύματα, κολλοειδή και εναιώρημα." Διαλύματα, κολλοειδή και εναιώρημα . N.p., 29 Mar. 2005. Web. 01 Φεβρουαρίου 2017.