Ποια είναι η ενεργή θέση ενός ενζύμου
Οι βιοχημικές αντιδράσεις στα ζωντανά κύτταρα καταλύονται από ένζυμα. Τα ένζυμα συντίθενται στην ανενεργή τους μορφή η οποία στη συνέχεια μετατρέπεται στην ενεργό μορφή. Η δραστηριότητα ενός ενζύμου προσδιορίζεται από την αλληλουχία αμινοξέων της πρωτογενούς δομής. Τα υποστρώματα συνδέονται με την ενεργό θέση του ενζύμου για να επιταχύνουν ειδικά μια συγκεκριμένη χημική αντίδραση. Η ενεργή θέση ενός ενζύμου περιλαμβάνει μια θέση δέσμευσης υποστρώματος και μια καταλυτική θέση. Το συγκεκριμένο χημικό περιβάλλον, το οποίο αναπτύσσεται από τα υπολείμματα αμινοξέων στη δραστική θέση, καθορίζει ποια υποστρώματα είναι ικανά να συνδεθούν με το ένζυμο.
Αυτό το άρθρο εξηγεί,
1. Τι είναι τα ένζυμα και πώς λειτουργούν
2. Ποια είναι η ενεργή θέση ενός ενζύμου
3. Πώς δεσμεύονται ένα ένζυμο και ένα υπόστρωμα
Τι είναι τα ένζυμα και πώς λειτουργούν
Ένα ένζυμο είναι ένα μόριο πρωτεΐνης που μπορεί να λειτουργήσει ως βιολογικός καταλύτης. Τα μόρια στα οποία δρουν τα ένζυμα ονομάζονται υποστρώματα. Τα διαφορετικά μόρια που δημιουργούνται από τη δράση ενός ενζύμου σε ένα συγκεκριμένο υπόστρωμα ονομάζονται προϊόντα. Τα ένζυμα καταλύουν βιοχημικές αντιδράσεις μειώνοντας την ενέργεια ενεργοποίησής του. Η κατάλυση της αντίδρασης από ένα ένζυμο αυξάνει τον ρυθμό της συγκεκριμένης αντίδρασης στο κύτταρο. Ορισμένα ένζυμα είναι ικανά να καταλύουν την ίδια αντίδραση. Ονομάζονται ισοένζυμα. Ένα μοναδικό σύνολο περίπου 3.000 ενζύμων είναι γενετικά προγραμματισμένο να συντίθεται, δίνοντας μια ατομικότητα σε ένα κύτταρο. Εκτός από τις πρωτεΐνες, τα μόρια RNA όπως τα ριβοένζυμα μπορούν επίσης να λειτουργήσουν ως ένζυμα. Εάν ένα ένζυμο γίνει ελαττωματικό, το αποτέλεσμα θα ήταν καταστροφικό.
Τα ένζυμα διαθέτουν τρία χαρακτηριστικά γνωρίσματα. Η κύρια λειτουργία ενός ενζύμου είναι να αυξάνει τον ρυθμό μιας αντίδρασης. Δεύτερον, ένα συγκεκριμένο ένζυμο δρα ειδικά σε ένα συγκεκριμένο υπόστρωμα, παράγοντας ένα προϊόν. Τρίτον, τα ένζυμα μπορούν να ρυθμιστούν από χαμηλή δραστηριότητα σε υψηλή δραστηριότητα και αντίστροφα. Η σύνδεση ενός υποστρώματος σε ένα ένζυμο, η δημιουργία του προϊόντος αυξάνοντας τον ρυθμό της αντίδρασης και την απελευθέρωση του προϊόντος φαίνονται στην εικόνα 1 .
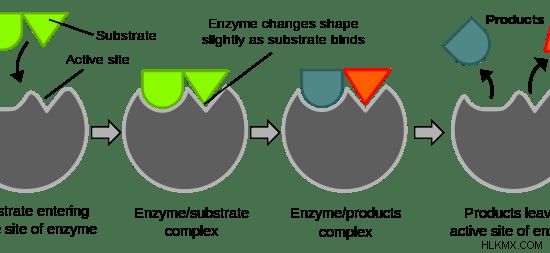
Εικόνα 1:Η δράση ενός ενζύμου
Η δραστηριότητα ενός ενζύμου εξαρτάται κυρίως από την αλληλουχία αμινοξέων της αλυσίδας πρωτεΐνης. Τα ένζυμα συντίθενται ως μια γραμμική αλληλουχία αμινοξέων που ονομάζεται πρωτογενής δομή τους. Η κύρια δομή αναδιπλώνεται αυθόρμητα σε μια τρισδιάστατη δομή που αποτελείται από άλφα έλικες και/ή φύλλα βήτα που ονομάζονται δευτερεύουσα δομή. Η δευτερεύουσα δομή του ενζύμου διπλώνει ξανά σε μια συμπαγή τρισδιάστατη δομή που ονομάζεται τριτοταγής δομή. Η τριτοταγής δομή του ενζύμου υπάρχει στην ανενεργή του μορφή.
Το πολυπεπτιδικό ή πρωτεϊνικό τμήμα του συμπλέγματος ενζύμου αναφέρεται ως αποένζυμο. Η ανενεργή μορφή του αποενζύμου στην αρχικά συντεθειμένη δομή είναι γνωστή ως προένζυμο ή ζυμογόνο. Αρκετά αμινοξέα αφαιρούνται από το ζυμογόνο προκειμένου να μετατραπεί το πολυπεπτιδικό τμήμα σε αποένζυμο. Τις περισσότερες φορές, το αποένζυμο συνδυάζεται με άλλες ενώσεις που ονομάζονται συμπαράγοντες για να καταλύσει μια αντίδραση. Ο συνδυασμός αποενζύμου και συμπαράγοντα ονομάζεται ολοένζυμο. Η σχέση μεταξύ του αποένζυμου, του συμπαράγοντα και του ολοενζύμου φαίνεται στο εικόνα 2 .
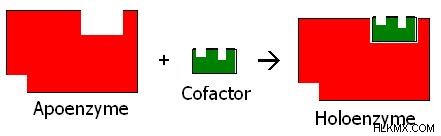
Εικόνα 2:Αποένζυμο, συμπαράγοντας και ολοένζυμο
Τι είναι η ενεργή θέση ενός ενζύμου
Η ενεργή θέση ενός ενζύμου είναι η περιοχή όπου συγκεκριμένα υποστρώματα συνδέονται με το ένζυμο, καταλύοντας τη χημική αντίδραση. Η θέση δέσμευσης του υποστρώματος μαζί με την καταλυτική θέση σχηματίζουν την ενεργό θέση του ενζύμου. Το ένζυμο συνδέεται με ένα συγκεκριμένο υπόστρωμα για να καταλύσει μια χημική αντίδραση που αλλάζει το υπόστρωμα με κάποιο τρόπο. Το υπόστρωμα είναι μικρότερο σε μέγεθος από το ένζυμο του. Το υπόστρωμα είναι τέλεια προσανατολισμένο μέσα στο ένζυμο από τη δραστική θέση. Μία ή περισσότερες θέσεις δέσμευσης υποστρώματος μπορούν να βρεθούν σε ένα ένζυμο. Η καταλυτική θέση εμφανίζεται δίπλα στη θέση δέσμευσης, πραγματοποιώντας την κατάλυση. Αποτελείται από περίπου δύο έως τέσσερα αμινοξέα που συμμετέχουν στην κατάλυση. Τα αμινοξέα που σχηματίζουν τη δραστική θέση βρίσκονται σε διακριτά μέρη της αλληλουχίας αμινοξέων του ενζύμου. Επομένως, η πρωταρχική δομή του ενζύμου θα πρέπει να διπλωθεί στην τρισδιάστατη δομή του, επιτρέποντας στην ενεργό θέση να ενωθεί. Η ενεργή θέση του ενζύμου, η λυσοζύμη, φαίνεται στο εικόνα 3 . Το υπόστρωμα, η πεπτιδογλυκάνη, εμφανίζεται με μαύρο χρώμα.
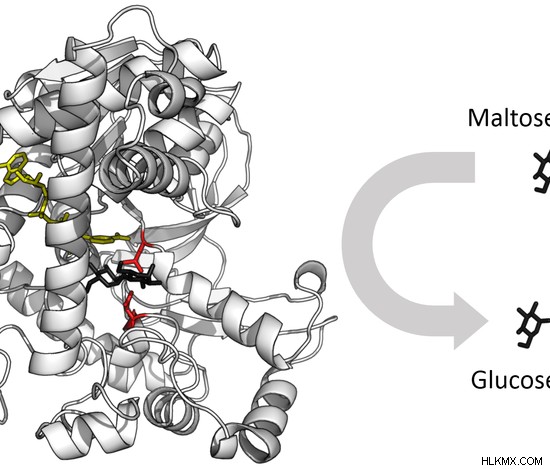
Εικόνα 3:Ενεργή θέση του ενζύμου
Από την ενεργό θέση, τα ένζυμα περιέχουν θύλακες που συνδέονται με μόρια τελεστών, αλλάζοντας τη διαμόρφωση ή τη δυναμική του ενζύμου. Αυτοί οι θύλακες είναι γνωστοί ως αλλοστερικές θέσεις που εμπλέκονται στην αλλοστερική ρύθμιση του ρυθμού αντίδρασης του ενζύμου.
Πώς συνδέονται ένα ένζυμο και ένα υπόστρωμα
Η θέση δέσμευσης του ενζύμου συνδέεται με το υπόστρωμα με συγκεκριμένο τρόπο για το υπόστρωμα. Αυτή η σύνδεση προσανατολίζει το υπόστρωμα για κατάλυση. Τα υπολείμματα αμινοξέων που βρίσκονται στη θέση δέσμευσης του ενζύμου μπορεί να είναι ασθενώς όξινα ή βασικά. υδρόφιλο ή υδρόφοβο. και θετικά φορτισμένο, αρνητικά φορτισμένο ή ουδέτερο. Το πολύ συγκεκριμένο χημικό περιβάλλον που δημιουργείται μέσα στη θέση δέσμευσης καθορίζει την ειδικότητα ενός ενζύμου. Προσωρινές ομοιοπολικές αλληλεπιδράσεις όπως δυνάμεις van der Waals, υδρόφιλες/υδρόφοβες αλληλεπιδράσεις ή δεσμοί υδρογόνου σχηματίζονται από την ενεργό θέση με το υπόστρωμα. Το ένζυμο μαζί με το υπόστρωμα σχηματίζουν το σύμπλεγμα ενζύμου-υποστρώματος.
Η δέσμευση του υποστρώματος με το ένζυμο μπορεί να συμβεί με δύο μηχανισμούς:μοντέλο κλειδώματος και κλειδιού και μοντέλο επαγόμενης προσαρμογής. Το μοντέλο κλειδώματος και κλειδιού υποστηρίζει ότι το υπόστρωμα ταιριάζει ακριβώς με το ένζυμο σε ένα στιγμιαίο βήμα. Η δέσμευση αλλάζει ελαφρώς τη δομή του ενζύμου. Μόνο τα σωστά μεγέθη και διαμορφωμένα υποστρώματα μπορούν να συνδεθούν με το ένζυμο στο μοντέλο κλειδώματος και κλειδιού. Κατά τη διάρκεια του μοντέλου επαγόμενης προσαρμογής , το σχήμα της ενεργού θέσης του ενζύμου αλλάζει συνεχώς ως απόκριση στη δέσμευση του υποστρώματος. Αυτό εξηγεί γιατί άλλα μόρια συνδέονται με την ενεργό θέση του ενζύμου. Ωστόσο, αυτή η δυναμική σύνδεση του υποστρώματος με ένα ένζυμο σταθεροποιεί το υπόστρωμα και αυξάνει τον ρυθμό της βιοχημικής αντίδρασης. Η εξοκινάση είναι ένα ένζυμο που αλλάζει το σχήμα του, προσαρμόζεται στα σχήματα των υποστρωμάτων του, της τριφωσφορικής αδενίνης και της ξυλόζης. Το επαγόμενο μοντέλο προσαρμογής της εξοκινάσης φαίνεται στο σχήμα 4 . Οι θέσεις δέσμευσης και τα υποστρώματα εμφανίζονται με μπλε και μαύρο χρώμα.
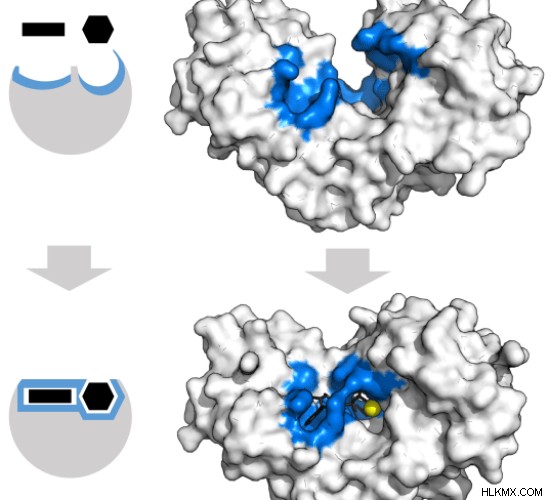
Εικόνα 4:Μοντέλο επαγόμενης προσαρμογής της εξοκινάσης
Η κατάλυση μιας χημικής αντίδρασης από ένα ένζυμο μπορεί να συμβεί με διάφορους τρόπους που μειώνουν την ενέργεια ενεργοποίησης της χημικής αντίδρασης. Πρώτον, τα ένζυμα σταθεροποιούν τη μεταβατική κατάσταση δημιουργώντας συμπληρωματική κατανομή φορτίου σε αυτήν της μεταβατικής κατάστασης, μειώνοντας την ενέργειά του. Δεύτερον, τα ένζυμα προάγουν μια εναλλακτική οδό αντίδρασης που περιέχει μια δεύτερη μεταβατική κατάσταση με χαμηλότερη ενέργεια σε εκείνη της αρχικής μεταβατικής κατάστασης. Τρίτον, τα ένζυμα αποσταθεροποιούν τη βασική κατάσταση του υποστρώματος.
Συμπέρασμα
Τα ένζυμα είναι χημικές αντιδράσεις που αυξάνουν τον ρυθμό των βιοχημικών αντιδράσεων στα ζωντανά κύτταρα. Τα περισσότερα από τα ένζυμα είναι πρωτεΐνες που συντίθενται στην πρωτογενή τους δομή. Αυτές οι αλυσίδες αμινοξέων διπλώνονται στις τρισδιάστατες δομές τους, παράγοντας την ενεργή μορφή των ενζύμων. Αυτή η αναδίπλωση δημιουργεί μια τσέπη στο ένζυμο που ονομάζεται ενεργή θέση. Τα υποστρώματα συνδέονται ειδικά με την ενεργό θέση του ενζύμου, αυξάνοντας τον ρυθμό των βιοχημικών αντιδράσεων που συμβαίνουν στο σώμα.
Αναφορά: Εικόνα Ευγενική προσφορά:
1."Ο ρόλος των ενζύμων στις βιοχημικές αντιδράσεις." Ένζυμα. Ν.π., ν.δ. Ιστός. 21 Μαΐου 2017.
2 "Ένζυμα και η ενεργή θέση." Ακαδημία Khan. Ν.π., ν.δ. Ιστός. 21 Μαΐου 2017.
3 "Ειδικότητα ενεργού θέσης και υποστρώματος ενζύμου." Απεριόριστος. 17 Νοεμ. 2016. Web. 21 Μαΐου 2017.
1. "Διάγραμμα επαγόμενης προσαρμογής" Από Δημιουργία από την TimVickers, διανυσματική από τον Fvasconcellos – Παρέχεται από την TimVickers (Δημόσιος Τομέας) μέσω του Commons Wikimedia
2. «Enzymes» του Thomas Shafee – Δικό έργο (CC BY 4.0) μέσω Commons Wikimedia
3. «Δομή ενζύμου» Του Thomas Shafee – Δική μου εργασία (CC BY 4.0) μέσω Commons Wikimedia
4. «Εξοκινάση που προκαλείται προσαρμογή» Του Thomas Shafee – Δική μου εργασία (CC BY 4.0) μέσω Commons Wikimedia




