Διαφορά μεταξύ άνθρακα 12 και άνθρακα 14
Κύρια διαφορά – Άνθρακα 12 έναντι άνθρακα 14
Ορισμένα στοιχεία μπορεί να υπάρχουν σε διαφορετικές μορφές γνωστές ως ισότοπα. Τα ισότοπα ενός στοιχείου περιέχουν τον ίδιο αριθμό ηλεκτρονίων και πρωτονίων, αλλά διαφορετικό αριθμό νετρονίων. Επομένως, ακόμα κι αν έχει το ίδιο στοιχείο, η μάζα τους είναι διαφορετική. Ο μαζικός αριθμός ενός στοιχείου είναι το άθροισμα των νετρονίων και των πρωτονίων στον πυρήνα του. Έτσι, τα ισότοπα συμβολίζονται με τον μαζικό τους αριθμό. Για παράδειγμα, ο άνθρακας είναι ένα στοιχείο που υπάρχει σε τρεις μορφές. Με άλλα λόγια, ο άνθρακας έχει τρία ισότοπα:άνθρακα-12, άνθρακα-13 και άνθρακα-14. Ο μαζικός αριθμός του άνθρακα-12 είναι δώδεκα καθώς περιέχει 6 νετρόνια και 6 πρωτόνια. Ομοίως, το ισότοπο άνθρακα-13 περιέχει 7 νετρόνια και 6 πρωτόνια, ενώ το ισότοπο άνθρακα-14 περιέχει 8 νετρόνια και 6 πρωτόνια. Τα περισσότερα στοιχεία με ισότοπα έχουν ένα κύριο ισότοπο που υπάρχει άφθονα στη φύση, ενώ τα υπόλοιπα ισότοπα υπάρχουν σε πολύ μικρές αναλογίες. Ως εκ τούτου, όταν εξετάζουμε τη σχετική ατομική μάζα ενός στοιχείου, συνήθως θεωρείται ότι ο σχετικός μαζικός αριθμός είναι ίσος με τον μαζικό αριθμό του κύριου ή άφθονα υπάρχοντος ισοτόπου. Η κύρια διαφορά μεταξύ των ισοτόπων άνθρακα 12 και άνθρακα 14 είναι η σταθερότητά τους; Το ισότοπο άνθρακα 12 είναι πιο σταθερό από τον άνθρακα 14 .
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Carbon 12
– Ορισμός, Δομή, Ιδιότητες
2. Τι είναι ο άνθρακας 14
– Ορισμός, Δομή, Ιδιότητες
3. Ποια είναι η διαφορά μεταξύ του Carbon 12 και του Carbon 14
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ισότοπα, άνθρακας, ισότοπα άνθρακα, αριθμός μάζας, νετρόνια, άνθρακας 12, άνθρακας 14, ραδιενέργεια, σταθερά Avogadro 
Τι είναι ο άνθρακας 12
Το ισότοπο άνθρακα-12 είναι το πιο άφθονο ισότοπο άνθρακα που αποτελεί περίπου το 98,89% του συνόλου του φυσικού άνθρακα. Βρίσκεται σε όλα τα βιολογικά συστήματα. Το άτομο άνθρακα-12 περιέχει 6 νετρόνια και 6 πρωτόνια στον πυρήνα του. Το ισότοπο άνθρακα-12 είναι σταθερό και δεν είναι ραδιενεργό. Επομένως, δεν αποσυντίθεται, σε αντίθεση με τον άνθρακα-14. Το άτομο άνθρακα-12 χρησιμοποιείται για τον καθορισμό της σχετικής κλίμακας ατομικής μάζας, όπου οι μάζες άλλων ατόμων συγκρίνονται με τη μάζα ενός ατόμου του ισοτόπου άνθρακα-12. Εδώ, ο άνθρακας-12 λαμβάνεται ως το τυπικό άτομο. Η σχετική ατομική μάζα (RAM) των στοιχείων φαίνεται στον περιοδικό πίνακα. Ακριβώς όπως η μνήμη RAM, το mole βασίζεται στο ισότοπο άνθρακα-12. Ο αριθμός των ατόμων σε 12,00 g άνθρακα-12 λαμβάνεται ως πρότυπο για τον καθορισμό του mol. Ο ακριβής αριθμός ατόμων σε 12 g άνθρακα-12 βρέθηκε ότι είναι 6,02 x 10 . Ένας Ιταλός χημικός, ο Amedeo Avogadro ανακάλυψε αυτόν τον αριθμό τον δέκατο ένατο αιώνα. Αυτός ο αριθμός ορίζεται ως η σταθερά Avogadro . Η μονάδα της σταθεράς Avogadro είναι mol.
Τι είναι ο άνθρακας 14
Ο άνθρακας-14 είναι το ασταθές ισότοπο του άνθρακα και περιέχει 8 νετρόνια και 6 πρωτόνια. Επομένως ο μαζικός αριθμός είναι 14. Σε αντίθεση με άλλα ισότοπα άνθρακα, ο άνθρακας-14 είναι ραδιενεργός. έτσι, φθείρεται με το χρόνο. Το ισότοπο άνθρακα-14 αποτελεί περίπου λιγότερο από το 0,01% του συνόλου του φυσικού άνθρακα. Η δράση αποσύνθεσης του άνθρακα-14 είναι αυθόρμητη. Ο άνθρακας-14 διασπάται για να σχηματίσει άτομο αζώτου-14. Οι οργανισμοί αποκτούν άνθρακα-14 κατά τη φωτοσύνθεση ή όταν τρώνε οργανική ύλη. Όταν ο οργανισμός πεθαίνει, σταματά να λαμβάνει πηγές άνθρακα-14. Με αυτό, ο άνθρακας-14 αρχίζει να αποσυντίθεται και γίνεται το ήμισυ της αρχικής του ποσότητας σε περίπου 5730 χρόνια, που ονομάζεται χρόνος ημιζωής του άνθρακα-14. Η υπολειπόμενη ποσότητα άνθρακα-14 μπορεί να μετρηθεί και να συγκριθεί με την ποσότητα που υπάρχει στα περισσότερα ζωντανά δείγματα. Κάνοντας αυτό, οι επιστήμονες μπορούν να αποφασίσουν την ηλικία των απολιθωμάτων χρησιμοποιώντας άνθρακα-14. Ωστόσο, ο άνθρακας-14 εφαρμόζεται σε απολιθώματα που είναι παλαιότερα από 50.000 χρόνια, επειδή η ραδιενέργεια του ισοτόπου άνθρακα-14 γίνεται πολύ αργή μετά από 50.000 χρόνια.
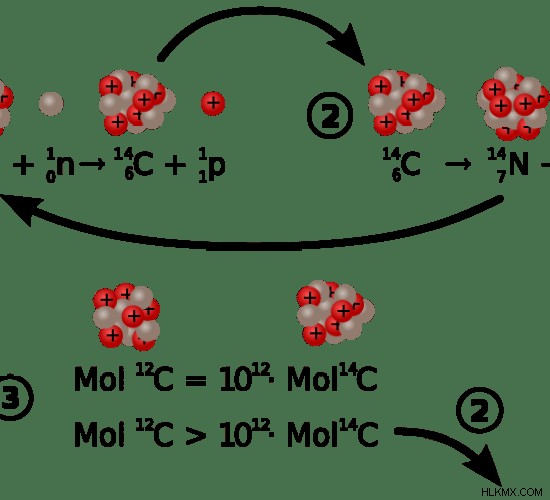
Εικόνα 1:Σχηματισμός και διάσπαση του άνθρακα-14
Διαφορά μεταξύ άνθρακα 12 και άνθρακα 14
Μαζικός αριθμός
Άνθρακας-12: Ο μαζικός αριθμός του άνθρακα-12 είναι δώδεκα.
Άνθρακας-14: Ο μαζικός αριθμός του άνθρακα-14 είναι δεκατέσσερις.
Αριθμός νετρονίων σε ένα άτομο
Άνθρακας-12: Ο άνθρακας-12 έχει έξι νετρόνια.
Άνθρακας-14: Ο άνθρακας-14 έχει οκτώ νετρόνια.
Σταθερότητα
Άνθρακας-12: Ο άνθρακας-12 είναι σταθερός.
Άνθρακας-14: Ο άνθρακας-14 είναι ασταθής.
Ραδιενέργεια
Άνθρακας-12: Ο άνθρακας-12 δεν είναι ραδιενεργός.
Άνθρακας-14: Ο άνθρακας-14 είναι ραδιενεργός.
Εφαρμογή
Άνθρακας-12: Ο άνθρακας-12 είναι το δομικό στοιχείο όλων των βιολογικών συστημάτων.
Άνθρακας-14: Ο άνθρακας-14 χρησιμοποιείται για τη μέτρηση της ηλικίας των απολιθωμάτων που χρονολογείται από 50.000 χρόνια.
Κατανομή ισοτόπων
Άνθρακας-12: Ο άνθρακας-12 βρίσκεται στο 99% όλων των φυσικών ανθράκων.
Άνθρακας-14: Ο άνθρακας-124 αποτελεί λιγότερο από το 0,01% όλων των φυσικών ανθράκων.
Συμπέρασμα
Ο άνθρακας-12 και ο άνθρακας-14 είναι δύο τύποι ισοτόπων άνθρακα. Ο άνθρακας-12 είναι το πιο άφθονο ισότοπο άνθρακα και είναι σταθερό λόγω της απουσίας ραδιενέργειας. Ωστόσο, ο άνθρακας-14 δεν είναι σταθερός λόγω της ραδιενέργειας του. Εξαιτίας αυτού, ο άνθρακας-14 βρίσκεται πολύ σπάνια σε βιολογικά συστήματα. Αυτή είναι η διαφορά μεταξύ άνθρακα-12 και άνθρακα-14.
Αναφορά:
1.Breithaupt, Jim. Φυσική (Palgrave Foundations Series). N.p.:Palgrave Macmillan;, 2010. Εκτύπωση.
2.Knorr, Susan. Μαθαίνοντας για τα άτομα. Greensboro, NC:Mark Twain Media, 2004. Εκτύπωση.
Εικόνα Ευγενική προσφορά:
1"Σχηματισμός και αποσύνθεση άνθρακα 14" Από C14_methode_physikalische_grundlagen.svg:Παράγωγο έργο Sgbeer:NikNaks talk – γκαλερί – wikipedia – C14_methode_physikalische_grundlagen.svg (CC BY-SA 3.0 Wikimedia Via)




