Διαφορά μεταξύ αμίνης και αμιδίου
Κύρια διαφορά – Αμίνη εναντίον Αμιδίου
Οι αμίνες και τα αμίδια είναι δύο τύποι ενώσεων που βρίσκονται στον τομέα της οργανικής χημείας. Αν και και οι δύο τύποι αποτελούνται από άτομα αζώτου μαζί με άλλα άτομα, υπάρχουν διακριτά χαρακτηριστικά και ιδιότητες στις αμίνες και τα αμίδια. Η κύρια διαφορά μεταξύ αμίνης και αμιδίου είναι η παρουσία μιας καρβονυλικής ομάδας στη δομή τους. Οι αμίνες δεν έχουν καρβονυλικές ομάδες συνδεδεμένες με το άτομο αζώτου ενώ τα αμίδια έχουν μια ομάδα καρβονυλίου συνδεδεμένη με ένα άτομο αζώτου.
Βασικές περιοχές που καλύπτονται
1. Τι είναι μια αμίνη
– Ορισμός, Δομή, Ιδιότητες, Ταξινόμηση
2. Τι είναι ένα αμίδιο
– Ορισμός, δομή, ιδιότητες, ταξινόμηση
3. Ποιες είναι οι ομοιότητες μεταξύ της αμίνης και του αμιδίου
– Κοινές ιδιότητες
4. Ποια είναι η διαφορά μεταξύ αμίνης και αμιδίου
– Σύγκριση βασικών διαφορών
Βασικοί όροι:αμίνη, αμίδιο, αλειφατικό αμίδιο, αλειφατική αμίνη, αρωματικό αμίδιο, αρωματική αμίνη, πρωτεύον αμίδιο, πρωτοταγής αμίνη, δευτερογενές αμίδιο, δευτεροταγής αμίνη, τριτοταγές αμίδιο, τριτοταγής αμίνη, 
Τι είναι η αμίνη;
Μια αμίνη είναι ένα παράγωγο της αμμωνίας. Αποτελείται από μία ή περισσότερες αλκυλομάδες που αντικαθιστούν τα άτομα υδρογόνου στην αμμωνία (NH3 ) μόριο. Επομένως, η αλκυλομάδα συνδέεται απευθείας με το άτομο αζώτου. Σύμφωνα με τον αριθμό των αλκυλομάδων που έχουν προσκολληθεί στο άτομο αζώτου, οι αμίνες κατηγοριοποιούνται σε τρεις ευρείες ομάδες.
Ταξινόμηση της αμίνης
Πρωτοταγείς Αμίνες – Μία ομάδα αλκυλίου συνδέεται με το άτομο αζώτου.
Δευτερογενείς αμίνες – Δύο ομάδες αλκυλίου συνδέονται με το άτομο αζώτου.
Τριτοταγείς Αμίνες – Τρεις αλκυλομάδες συνδέονται με το άτομο αζώτου.
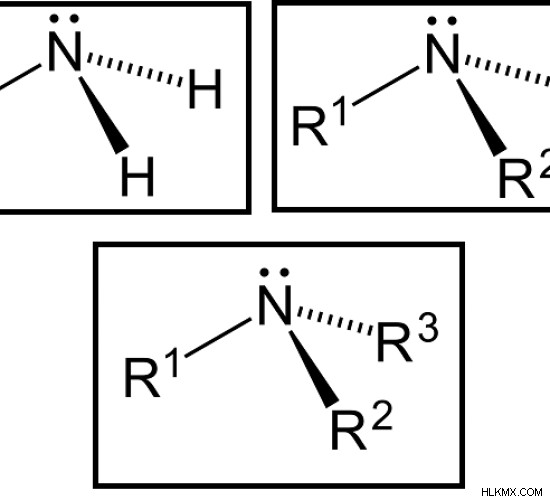
Εικόνα 1:Πρωτοταγής αμίνη (αριστερά), Δευτερεύουσα αμίνη (δεξιά), Τριτοταγής αμίνη (κάτω) Σημειώστε ότι οι ομάδες R1 και R2 μπορεί να είναι ίδιες ή διαφορετικές σε δευτεροταγείς και τριτοταγείς αμίνες.
Ανάλογα με τον τύπο της αλκυλομάδας που έχει προσκολληθεί, οι αμίνες ταξινομούνται περαιτέρω ως,
Αλιφατικές αμίνες – Δεν υπάρχουν δομές δακτυλίου
Αρωματικές αμίνες – Παρούσες δομές δακτυλίου
Οι αλειφατικές αμίνες έχουν γραμμικές ή διακλαδισμένες αλκυλομάδες συνδεδεμένες απευθείας με το άτομο αζώτου. Οι αρωματικές αμίνες έχουν άτομο αζώτου απευθείας συνδεδεμένο με μια δομή αρωματικού δακτυλίου.
Οι πρωτοταγείς και οι δευτεροταγείς αμίνες έχουν άτομα Η συνδεδεμένα απευθείας με το άτομο αζώτου. Επομένως, οι πρωτοταγείς και δευτεροταγείς αμίνες είναι ικανές να έχουν δεσμούς υδρογόνου. Οι τριτοταγείς αμίνες δεν έχουν άτομα Η για τη δημιουργία δεσμών υδρογόνου. Αλλά όλοι οι τύποι αμινών μπορούν να έχουν διαμοριακούς δεσμούς υδρογόνου με το νερό (H2 Ο) λόγω της παρουσίας ενός μοναχικού ζεύγους ηλεκτρονίων στο άτομο του αζώτου. Επομένως, αμίνες με χαμηλό μοριακό βάρος μπορούν να διαλυθούν στο νερό.
Όπως η αμμωνία, οι αμίνες λειτουργούν επίσης ως βάσεις. Οι λόγοι της βασικότητας περιλαμβάνουν την παρουσία ενός μοναχικού ζεύγους στο άτομο αζώτου, την παρουσία αλκυλομάδων (οι αλκυλομάδες ενισχύουν τη βασικότητα των ενώσεων δίνοντας ηλεκτρόνια στο άτομο αζώτου) κ.λπ.
Τι είναι ένα αμίδιο;
Τα αμίδια είναι οργανικές ενώσεις που έχουν μια καρβονυλ ομάδα συνδεδεμένη απευθείας με το άτομο αζώτου. Τα αμίδια μπορούν επίσης να ταξινομηθούν ως αλειφατικά και αρωματικά αμίδια. Τα αλειφατικά αμίδια ταξινομούνται σε τρεις ομάδες ως εξής.
Ταξινόμηση αμιδίων
Πρωτογενές αμίδιο – το άτομο αζώτου δεν είναι συνδεδεμένο με καμία αλκυλομάδα
Δευτερογενές αμίδιο – το άτομο αζώτου συνδέεται με μία μόνο αλκυλομάδα
Τριτογενές αμίδιο – το άτομο αζώτου συνδέεται με δύο αλκυλομάδες
Τα αμίδια προέρχονται από αποπρωτονιωμένη αμμωνία. Αυτή η αποπρωτονιωμένη αμμωνία μπορεί να προσκολληθεί σε μια ακυλομάδα (R-C=O) και να σχηματίσει ένα αμίδιο. Τα αμίδια σχηματίζονται επίσης από καρβοξυλικά οξέα. Εκεί, η ομάδα υδροξυλίου (-ΟΗ) του καρβοξυλικού οξέος αντικαθίσταται με αποπρωτονιωμένη αμμωνία.
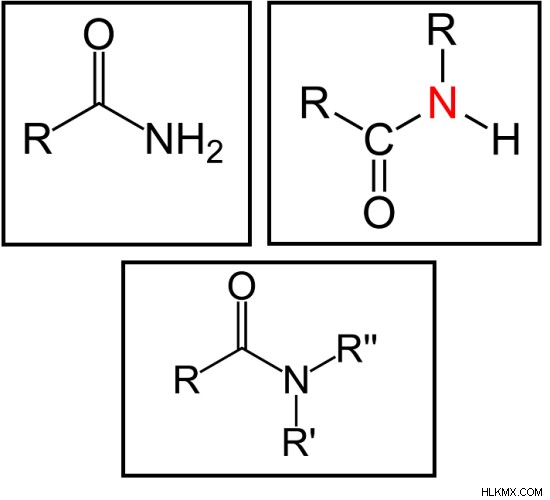
Εικόνα 2:Πρωτεύοντα (αριστερά), Δευτερεύοντα (δεξιά) και Τριτοταγή (κάτω) αμίδια
Ομοιότητες μεταξύ αμίνης και αμιδίου
- Τόσο οι αμίνες όσο και τα αμίδια είναι διαλυτά στο νερό λόγω της παρουσίας μιας ομάδας –NH.
- Αυτές οι ομάδες –NH μπορούν να δημιουργήσουν διαμοριακούς δεσμούς υδρογόνου με μόρια νερού.
- Οι αμίνες και τα αμίδια ταξινομούνται σε αλειφατικές και αρωματικές ενώσεις με βάση την παρουσία ή την απουσία δομής δακτυλίου.
- Οι αμίνες και τα αμίδια ταξινομούνται επίσης ως πρωτοταγείς, δευτεροταγείς ή τριτοταγείς ενώσεις ανάλογα με τον αριθμό των αλκυλομάδων που συνδέονται με το άτομο αζώτου
Διαφορά μεταξύ αμίνης και αμιδίου
Ορισμός
Αμίνη: Η αμίνη είναι μια οργανική ένωση που αποτελείται από ένα ή περισσότερα άτομα αζώτου συνδεδεμένα με αλκυλομάδες.
Αμίδιο: Το αμίδιο είναι μια οργανική ένωση που αποτελείται από ομάδα αποπρωτονιωμένου αμμωνίου με ομάδα ακυλίου.
Δομή
Αμίνη: Οι αμίνες δεν έχουν καρβονυλικές ομάδες στη δομή τους.
Αμίδιο: Τα αμίδια έχουν καρβονυλικές ομάδες.
Άτομα
Αμίνη: Οι αμίνες αποτελούνται από άτομα C, H και N.
Αμίδιο: Τα αμίδια αποτελούνται από άτομα C, H, N και O.
Χημικές ιδιότητες
Αμίνη: Οι αμίνες δείχνουν βασικότητα.
Αμίδιο: Τα αμίδια παρουσιάζουν όξινα χαρακτηριστικά.
Φυσική κατάσταση
Αμίνη: Οι περισσότερες αμίνες χαμηλού μοριακού βάρους είναι αέρια σε θερμοκρασία δωματίου ή εξατμίζονται εύκολα.
Αμίδιο: Τα περισσότερα αμίδια είναι στερεά σε θερμοκρασία δωματίου.
Σημεία βρασμού
Αμίνη: Οι αμίνες έχουν σχετικά χαμηλότερα σημεία βρασμού.
Αμίδιο: Τα αμίδια έχουν σχετικά υψηλά σημεία βρασμού.
Συμπέρασμα
Τόσο οι αμίνες όσο και τα αμίδια είναι οργανικές ενώσεις που περιέχουν άζωτο (Ν). Διαφέρουν όμως μεταξύ τους ανάλογα με τις φυσικές και χημικές τους ιδιότητες. Η κύρια διαφορά μεταξύ αμίνης και αμιδίου εξαρτάται από την παρουσία ή την απουσία καρβονυλικών ομάδων συνδεδεμένων με το άτομο αζώτου τους.




