Μεταλλική Συγκόλληση
Βασικές έννοιες
Σε αυτό το σεμινάριο, θα μάθετε για τη μεταλλική συγκόλληση, τα χαρακτηριστικά και τις ιδιότητές της, και ακόμη και μερικά παραδείγματα!
Θέματα που καλύπτονται σε άλλα άρθρα
- Ιωνικοί έναντι ομοιοπολικοί δεσμοί
- Πολικοί δεσμοί έναντι μη πολικών δεσμών
- Μέταλλα, Αμέταλλα, Μεταλλοειδή
- Ενθαλπία δεσμών και ενέργεια δεσμών
- Πολικοί-Ομοιοπολικοί δεσμοί
Ορισμός της μεταλλικής συγκόλλησης
Η σύντομη απάντηση:ο μεταλλικός δεσμός είναι ένας τύπος χημικού δεσμού μεταξύ δύο ή περισσότερων ατόμων μετάλλου, ο οποίος προκύπτει από την έλξη μεταξύ θετικά φορτισμένων μεταλλικών πυρήνων και των μη εντοπισμένων ηλεκτρονίων σθένους τους.
Στο υπόλοιπο αυτού του άρθρου, θα ρίξουμε μια ματιά στα διάφορα μέρη αυτού του ορισμού και θα αναλύσουμε τι σημαίνει και θα εξερευνήσουμε τις συνέπειες των αλληλεπιδράσεων μεταλλικών δεσμών!
Τι είναι ένας μεταλλικός δεσμός;
Οι μεταλλικοί δεσμοί δεν είναι διακριτούς κατευθυντικούς δεσμούς μεταξύ συγκεκριμένων ατόμων, επομένως είναι συχνά λογικό να μιλάμε για μεταλλικούς «δεσμούς» παρά για μεμονωμένους δεσμούς. Ποια είναι όμως τα χαρακτηριστικά αυτού του είδους δεσμού; Πρώτον, όπως υποδηλώνει το όνομα, αυτός ο τύπος συγκόλλησης βρίσκεται σε μέταλλα και κράματα μετάλλων. Ο δεσμός μεταξύ μετάλλων και αμετάλλων είναι συνήθως ιοντικός, ενώ ο δεσμός μεταξύ των μη μετάλλων είναι συνήθως ομοιοπολικός. Ωστόσο, σε ουσίες που περιέχουν μόνο άτομα μετάλλου, η αλληλεπίδραση που εμπλέκεται έχει διαφορετικό χαρακτήρα και την ονομάζουμε μεταλλικό δεσμό.
Χαρακτηριστικά μεταλλικής συγκόλλησης
Τα μεταλλικά στοιχεία έχουν χαμηλή ηλεκτραρνητικότητα, πράγμα που σημαίνει ότι συγκρατούν τα ηλεκτρόνια σθένους χαλαρά. Αυτός είναι ο λόγος που εγκαταλείπουν τα ηλεκτρόνια σθένους γύρω από τα ηλεκτραρνητικά άτομα για να σχηματίσουν ιοντικές ενώσεις. Ως αποτέλεσμα, όταν υπάρχουν μόνο άτομα μετάλλου γύρω, τα ηλεκτρόνια σθένους ενός ατόμου είναι δύσκολο να διακριθούν από αυτά των γειτόνων του. Όλα τα άτομα σε ένα κομμάτι μετάλλου μοιράζονται αυτά τα ηλεκτρόνια και μπορούν να ρέουν ελεύθερα σε ολόκληρο το υλικό. Πολλοί άνθρωποι χρησιμοποιούν τον όρο «θάλασσα ηλεκτρονίων» για να αναφερθούν σε αυτήν την κοινή δεξαμενή ηλεκτρονίων σθένους. Στο παρακάτω σχήμα, οι κίτρινες γραμμές περιγράμματος απεικονίζουν αυτή τη θάλασσα ηλεκτρονίων κατά προσέγγιση ως προς την πυκνότητα ηλεκτρονίων.
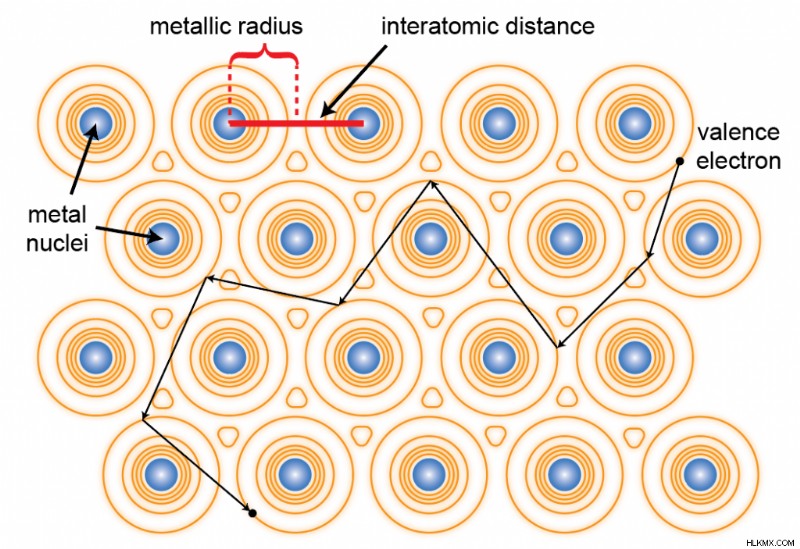
Υπάρχουν ορισμένες περιπτώσεις όπου τα ηλεκτρόνια μπορούν να ρέουν μέσω ομοιοπολικών ενώσεων, όπως σε συζευγμένα συστήματα pi. Ωστόσο, αυτό προέρχεται από την μετεγκατάσταση ηλεκτρονίων κατά μήκος συγκεκριμένων δεσμών και όχι από μια γενική κατανομή ηλεκτρονίων σε ολόκληρο το υλικό.
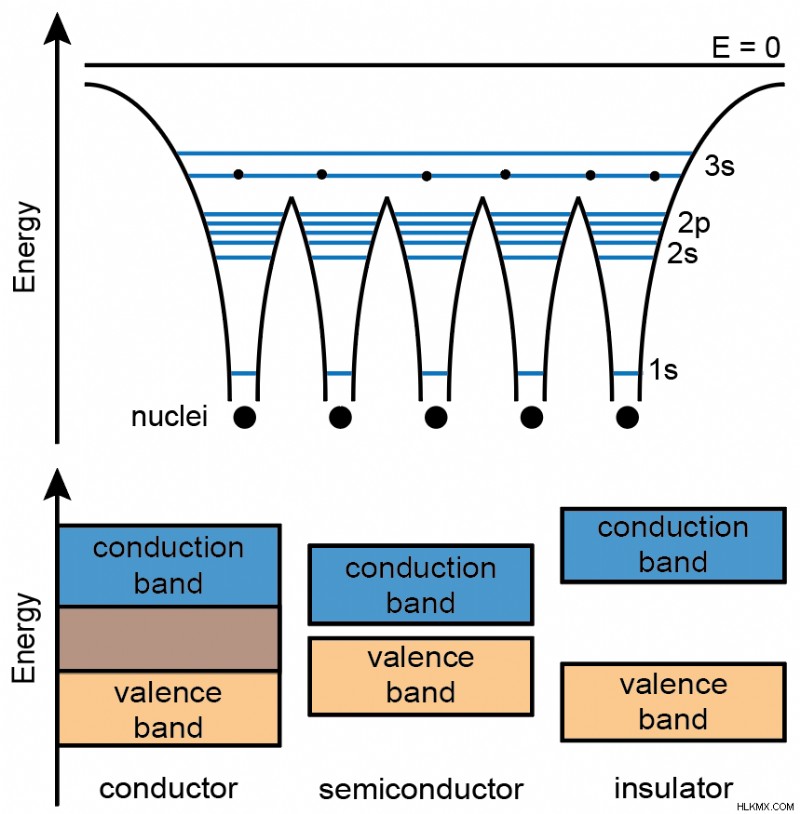
Μεταλλική Κρυσταλλική Δομή
Ένα άλλο χαρακτηριστικό του μεταλλικού δεσμού είναι ότι όλα τα πλησιέστερα γειτονικά άτομα συνδέονται πανομοιότυπα. Αυτό σημαίνει ότι οι μεταλλικοί κρύσταλλοι συνήθως οργανώνονται σε στενά μοτίβα, όπως εξάγωνο κλείσιμο ή κυβικό κλείσιμο.
Μεταλλικές ιδιότητες
Πολλές από τις ιδιότητες των μετάλλων προέρχονται από τη φύση των μεταλλικών δεσμών. Μεταξύ αυτών είναι η ηλεκτρική αγωγιμότητα, η θερμική αγωγιμότητα και η γυαλάδα.
Η ηλεκτρική αγωγιμότητα είναι η μεταφορά ηλεκτρονίων μέσω ενός υλικού ως απόκριση σε μια διαφορά δυναμικού. Η ηλεκτρική αγωγιμότητα προκύπτει κυρίως από ηλεκτρόνια στη ζώνη αγωγιμότητας ενός μετάλλου. Επειδή τα ηλεκτρόνια γεμίζουν πάντα τη ζώνη αγωγιμότητας στα μέταλλα, μπορούν πάντα να μεταφέρουν φορτίο αποτελεσματικά.
Η υψηλή θερμική αγωγιμότητα των μετάλλων προέρχεται επίσης από την κινητικότητα των ηλεκτρονίων. Τα ίδια τα άτομα συμβάλλουν στη μεταφορά θερμότητας, αλλά τα ηλεκτρόνια απορροφούν και μεταφέρουν επίσης κινητική ενέργεια.
Η γυαλάδα των μετάλλων προέρχεται από την υψηλή πυκνότητα των ηλεκτρονίων στην επιφάνεια του στερεού. Τα εισερχόμενα φωτόνια είναι πιο πιθανό να αντανακλούν αυτά τα ηλεκτρόνια παρά να μεταδίδουν ή να απορροφούν.
Παραδείγματα Μεταλλικής Συγκόλλησης
- Μέταλλα αλκαλίων, όπως το νάτριο και το κάλιο
- Μέταλλα αλκαλικών γαιών, όπως το ασβέστιο και το μαγνήσιο
- Μεταβατικά μέταλλα, όπως σίδηρος, τιτάνιο, χρυσός, βολφράμιο, χαλκός και ψευδάργυρος
- Κράματα, όπως μπρούτζος, κασσίτερος, ανοξείδωτος χάλυβας, ήλεκτρο και σκληρό αλουμίνιο




