Διαφορά μεταξύ πρωτογενών και δευτερογενών κυττάρων
Κύρια διαφορά – Πρωτεύον έναντι δευτερεύοντος κελιού
Οι μπαταρίες είναι στοιχεία που μπορούν να παράγουν ηλεκτρική ενέργεια. Μια μπαταρία μπορεί να έχει ένα ή περισσότερα ηλεκτροχημικά στοιχεία και αποτελείται από ακροδέκτες που μπορούν να συνδεθούν με εξωτερικές συσκευές που λειτουργούν με τροφοδοτικό. Οι κύριες και οι δευτερεύουσες κυψέλες είναι δύο τύποι μπαταριών. Η κύρια διαφορά μεταξύ των πρωτογενών και των δευτερευόντων κελιών είναι ότι τα κύρια κελιά μπορούν να χρησιμοποιηθούν μόνο μία φορά ενώ τα δευτερεύοντα κελιά μπορούν να χρησιμοποιηθούν περισσότερες από μία φορές.
Βασικές περιοχές που καλύπτονται
1. Τι είναι τα Πρωτογενή Κύτταρα
– Ορισμός, δομή, χημικές αντιδράσεις
2. Τι είναι τα Δευτερεύοντα Κύτταρα
– Ορισμός, δομή, χημικές αντιδράσεις
3. Ποια είναι η διαφορά μεταξύ των Κύριων και Δευτερευόντων Κελιών
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Μπαταρία, Πρωτεύον στοιχείο, Δευτερεύον στοιχείο, Άνοδος, Κάθοδος, Ηλεκτρισμός 
Τι είναι το Πρωτεύον κελί;
Οι κύριες κυψέλες ή οι κύριες μπαταρίες ονομάζονται επίσης μη επαναφορτιζόμενες μπαταρίες . Αυτό οφείλεται κυρίως στο ότι αυτές οι μπαταρίες δεν μπορούν να φορτιστούν ξανά όταν εξαντληθούν και σταματήσουν να λειτουργούν. Αν και δεν είναι επαναχρησιμοποιήσιμα, τα πρωτεύοντα στοιχεία είναι πολύ χρήσιμα για την αποθήκευση ενέργειας για μακροπρόθεσμη χρήση, επειδή ο ρυθμός αυτοεκφόρτισής τους είναι συγκριτικά χαμηλός. Ως εκ τούτου, η χρήση τους μπορεί να παρατηρηθεί σε βηματοδότες εξυπηρέτησης σε καρδιοπαθείς, έξυπνους μετρητές και στρατιωτικές εκστρατείες όπου η φόρτιση δεν είναι πρακτική και αδύνατη
Τα πρωτεύοντα κύτταρα δεν είναι επαναφορτιζόμενα λόγω των χημικών αντιδράσεων που συμβαίνουν στο εσωτερικό της μπαταρίας, οι οποίες είναι μη αναστρέψιμες. Οι χημικές αντιδράσεις χρησιμοποιούν όλες τις χημικές ουσίες που υπάρχουν στο κύτταρο και όταν χρησιμοποιούνται όλα τα χημικά είδη, η παραγωγή ενέργειας τερματίζεται.
Μια κύρια μπαταρία ή ένα πρωτεύον στοιχείο αποτελείται από μια άνοδο (θετικά φορτισμένο άκρο) και μια κάθοδο (αρνητικά φορτισμένο άκρο). Ο γραφίτης χρησιμοποιείται συνήθως ως κάθοδος και ο ψευδάργυρος ως άνοδος. Οι αντιδράσεις οξείδωσης συμβαίνουν στην άνοδο όπου τα ηλεκτρόνια δίνονται στο κύκλωμα και οι αντιδράσεις αναγωγής συμβαίνουν στην κάθοδο όπου τα ηλεκτρόνια γίνονται δεκτά από το εξωτερικό. Υπάρχει επίσης ένας ηλεκτρολύτης που είναι χρήσιμος για τη διέλευση του ηλεκτρικού ρεύματος. Ο ηλεκτρολύτης αποτελείται από ηλεκτρικά φορτισμένα ιόντα τα οποία μπορούν να μεταφέρουν το φορτίο τους μεταξύ καθόδου και ανόδου.
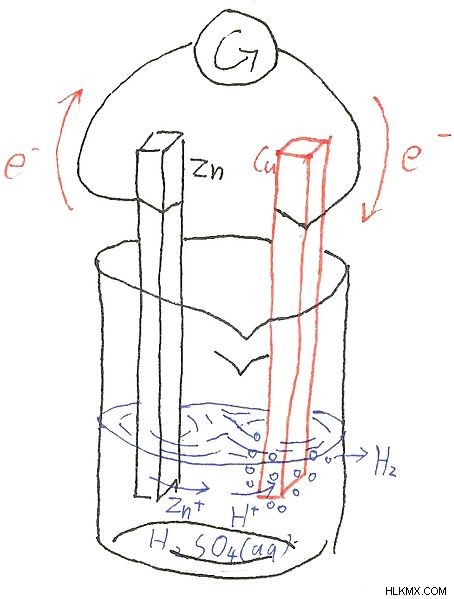
Εικόνα 1:Μια κύρια μπαταρία με άνοδο ψευδαργύρου και κάθοδο Cu
Ένα συνηθισμένο παράδειγμα πρωτεύοντος κελιού είναι το κελί Leclanche . Αποτελείται από άνοδο ψευδαργύρου και πορώδη κάθοδο γραφίτη. Ο ηλεκτρολύτης που υπάρχει μέσα στην μπαταρία είναι ένα υγρό μείγμα NH4 Cl (χλωριούχο αμμώνιο), χλωριούχος ψευδάργυρος (ZnCl2 ) και διοξείδιο του μαγγανίου (MnO2 ). Οι χημικές αντιδράσεις που συμβαίνουν μέσα στο κύτταρο μπορούν να δοθούν ως εξής.
Άνοδος: Zn(ες) → Zn(aq) + 2e
Κάθοδος: 2NH4 (aq) + 2e → 2NH3(g) + H2(g)
Δύο αέρια NH3 και H2 παράγονται στην κάθοδο. Αλλά αυτά τα αέρια και πάλι θα συμμετέχουν σε αντιδράσεις όπως φαίνεται παρακάτω.
2NH3(g) + Zn(aq) → [Zn(NH3 )2 ](aq)
2MnO2(s) + H2(g) →Mn2 O3(s) +H2 O(l)
Τι είναι ένα δευτερεύον κελί;
Τα δευτερεύοντα κύτταρα είναι επίσης γνωστά ως δευτερεύουσες μπαταρίες ή επαναφορτιζόμενες μπαταρίες . Αυτές οι μπαταρίες μπορούν να χρησιμοποιηθούν πολλές φορές αφού μπορούν να φορτιστούν όταν σταματήσουν να λειτουργούν. Οι χημικές αντιδράσεις που συμβαίνουν σε αυτές τις μπαταρίες είναι αναστρέψιμες. Αυτό σημαίνει ότι αυτές οι αντιδράσεις μπορούν να αντιστραφούν με την εφαρμογή ηλεκτρικού φορτίου. Αλλά σε αντίθεση με τις πρωτεύουσες μπαταρίες, οι δευτερεύουσες μπαταρίες πρέπει να φορτιστούν πριν από τη χρήση. Οι φορτιστές χρησιμοποιούνται για τη διαδικασία επαναφόρτισης.
Διαφορετικές δευτερεύουσες μπαταρίες παρέχουν διαφορετικές λειτουργίες. Επομένως, ο χρήστης πρέπει να γνωρίζει ποιος τύπος μπαταρίας πρέπει να χρησιμοποιηθεί για μια συγκεκριμένη ανάγκη.
Αυτές οι μπαταρίες έχουν επίσης κάθοδο και άνοδο όπως οι πρωτεύουσες μπαταρίες. Οι αντιδράσεις αναγωγής συμβαίνουν στην κάθοδο ενώ οι αντιδράσεις οξείδωσης συμβαίνουν στην άνοδο. Ένα καλό παράδειγμα για δευτερεύουσες κυψέλες είναι η μπαταρία αποθήκευσης μολύβδου/οξέος. Οι αντιδράσεις που συμβαίνουν μέσα σε αυτό το κελί φαίνονται παρακάτω.
Κάθοδος: PbO2(ες) + HSO4 (aq) + 3H(aq) + 2e → PbSO4(ες) + H2 O(l)
Άνοδος: Pb(α) + HSO4 (aq) → PbSO4(α) + H(aq) + 2e

Εικόνα 2:Σχηματικό διάγραμμα μπαταρίας μολύβδου οξέος.
Διαφορά μεταξύ πρωτευόντων και δευτερευόντων κελιών
Ορισμός
Κύρια κύτταρα: Τα κύρια κύτταρα είναι μπαταρίες που δεν μπορούν να επαναφορτιστούν ή να επαναχρησιμοποιηθούν.
Δευτερεύοντα κελιά: Οι δευτερεύουσες κυψέλες είναι μπαταρίες που μπορούν να επαναφορτιστούν και να επαναχρησιμοποιηθούν.
Χημικές αντιδράσεις
Κύρια κύτταρα: Στα πρωτογενή κύτταρα, εμφανίζονται μη αναστρέψιμες αντιδράσεις.
Δευτερεύοντα κελιά: Σε δευτερεύοντα κύτταρα, εμφανίζονται αναστρέψιμες αντιδράσεις.
Χρήση
Κύρια κύτταρα: Τα κύρια κελιά μπορούν να χρησιμοποιηθούν μόνο μία φορά.
Δευτερεύοντα κελιά: Τα δευτερεύοντα κελιά μπορούν να χρησιμοποιηθούν περισσότερες από μία φορές.
Σημασία
Κύρια κύτταρα: Τα πρωτεύοντα κύτταρα μπορούν να παράγουν ρεύμα αμέσως. Έτσι, χρησιμοποιούνται σε φορητές συσκευές.
Δευτερεύοντα κελιά: Τα δευτερεύοντα κελιά θα πρέπει να φορτίζονται πριν από τη χρήση. Έτσι μπορούν να χρησιμοποιηθούν σε αυτοκίνητα.
Ποσοστό αυτοεκφόρτισης
Κύρια κύτταρα: Οι κύριες κυψέλες έχουν χαμηλότερους ρυθμούς αυτοεκφόρτισης και μπορούν να χρησιμοποιηθούν για μακροπρόθεσμη αποθήκευση ισχύος.
Δευτερεύοντα κελιά: Τα δευτερεύοντα κύτταρα έχουν υψηλότερο ρυθμό αυτοεκφόρτισης σε σύγκριση με τα πρωτεύοντα κύτταρα.
Συμπέρασμα
Οι μπαταρίες είναι πολύ σημαντικές σε τεχνολογικές εφαρμογές. Όλες οι μπαταρίες είναι κατασκευασμένες από ηλεκτροχημικές κυψέλες. Οι πρωτογενείς και οι δευτερεύουσες κυψέλες είναι δύο τύποι μπαταριών που είναι χρήσιμοι στην καθημερινή ζωή. Η κύρια διαφορά μεταξύ πρωτογενών και δευτερευόντων κελιών είναι ότι τα πρωτεύοντα κελιά μπορούν να χρησιμοποιηθούν μόνο μία φορά, ενώ τα δευτερεύοντα κελιά μπορούν να χρησιμοποιηθούν περισσότερες από μία φορές.




