Διαφορά μεταξύ ηλεκτροαρνητικότητας και συγγένειας ηλεκτρονίων
Κύρια διαφορά – Ηλεκτραρνητικότητα έναντι συγγένειας ηλεκτρονίων
Ένα ηλεκτρόνιο είναι ένα υποατομικό σωματίδιο ενός ατόμου. Τα ηλεκτρόνια βρίσκονται παντού αφού κάθε ύλη αποτελείται από άτομα. Ωστόσο, τα ηλεκτρόνια είναι πολύ σημαντικά σε ορισμένες χημικές αντιδράσεις επειδή η ανταλλαγή ηλεκτρονίων είναι η μόνη διαφορά μεταξύ των αντιδρώντων και των προϊόντων σε αυτές τις αντιδράσεις. Η ηλεκτροαρνητικότητα και η συγγένεια ηλεκτρονίων είναι δύο όροι που εξηγούν τη συμπεριφορά των στοιχείων λόγω της παρουσίας ηλεκτρονίων. Η κύρια διαφορά μεταξύ ηλεκτραρνητικότητας και συγγένειας ηλεκτρονίων είναι ότι η ηλεκτραρνητικότητα είναι η ικανότητα ενός ατόμου να έλκει ηλεκτρόνια από έξω ενώ η συγγένεια ηλεκτρονίων είναι η ποσότητα ενέργειας που απελευθερώνεται όταν ένα άτομο αποκτά ένα ηλεκτρόνιο.
Βασικές περιοχές που καλύπτονται
1. Τι είναι η Ηλεκτραρνητικότητα
– Ορισμός, Μονάδες μέτρησης, Σχέση με Ατομικό Αριθμό, Σύνδεση
2. Τι είναι η συγγένεια ηλεκτρονίων
– Ορισμός, Μονάδες μέτρησης, Σχέση με Ατομικό Αριθμό
3. Ποια είναι η διαφορά μεταξύ της ηλεκτροαρνητικότητας και της συγγένειας ηλεκτρονίων
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Άτομο, Ηλεκτρόνιο, Συγγένεια ηλεκτρονίων, Ηλεκτραρνητικότητα, Ενδόθερμη Αντίδραση, Εξώθερμη Αντίδραση, Κλίμακα Pauling

Τι είναι η Ηλεκτραρνητικότητα
Η ηλεκτροαρνητικότητα είναι η ικανότητα ενός ατόμου να έλκει ηλεκτρόνια από το εξωτερικό. Αυτή είναι μια ποιοτική ιδιότητα ενός ατόμου και για να συγκριθούν οι ηλεκτραρνητικότητα των ατόμων σε κάθε στοιχείο, χρησιμοποιείται μια κλίμακα όπου βρίσκονται οι σχετικές τιμές ηλεκτραρνητικότητας. Αυτή η κλίμακα ονομάζεται «Κλίμακα Pauling .» Σύμφωνα με αυτή την κλίμακα, η υψηλότερη τιμή ηλεκτραρνητικότητας που μπορεί να έχει ένα άτομο είναι 4,0. Οι ηλεκτραρνητικότητες άλλων ατόμων δίνονται μια τιμή λαμβάνοντας υπόψη τις δυνατότητές τους να προσελκύουν ηλεκτρόνια.
Η ηλεκτροαρνητικότητα εξαρτάται από τον ατομικό αριθμό και το μέγεθος του ατόμου σε ένα στοιχείο. Όταν εξετάζουμε τον περιοδικό πίνακα, στο φθόριο (F) δίνεται η τιμή 4,0 για την ηλεκτραρνητικότητα του, καθώς είναι ένα μικρό άτομο και τα ηλεκτρόνια σθένους βρίσκονται κοντά στον πυρήνα. Έτσι, μπορεί να προσελκύσει εύκολα ηλεκτρόνια από το εξωτερικό. Επιπλέον, ο ατομικός αριθμός του Φθορίου είναι 9. έχει ένα κενό τροχιακό για ένα ακόμη ηλεκτρόνιο, προκειμένου να υπακούσει στον κανόνα της οκτάδας. Επομένως, το φθόριο προσελκύει εύκολα ηλεκτρόνια από το εξωτερικό.
Η ηλεκτροαρνητικότητα προκαλεί έναν δεσμό μεταξύ δύο ατόμων να είναι πολικός. Εάν ένα άτομο είναι πιο ηλεκτραρνητικό από το άλλο άτομο, το άτομο με την υψηλότερη ηλεκτραρνητικότητα μπορεί να προσελκύσει τα ηλεκτρόνια του δεσμού. Αυτό προκαλεί το άλλο άτομο να έχει μερικό θετικό φορτίο λόγω έλλειψης ηλεκτρονίων γύρω του. Επομένως, η ηλεκτραρνητικότητα είναι το κλειδί για την ταξινόμηση των χημικών δεσμών ως πολικούς ομοιοπολικούς, μη πολικούς ομοιοπολικούς και ιοντικούς δεσμούς. Οι ιονικοί δεσμοί εμφανίζονται μεταξύ δύο ατόμων με τεράστια διαφορά στην ηλεκτραρνητικότητα μεταξύ τους, ενώ οι ομοιοπολικοί δεσμοί εμφανίζονται μεταξύ των ατόμων με μια μικρή διαφορά στην ηλεκτραρνητικότητα μεταξύ των ατόμων.
Η ηλεκτραρνητικότητα των στοιχείων ποικίλλει περιοδικά. Ο περιοδικός πίνακας στοιχείων έχει καλύτερη διάταξη των στοιχείων σύμφωνα με τις τιμές ηλεκτραρνητικότητάς τους.

Εικόνα 1:Περιοδικός Πίνακας Στοιχείων μαζί με Ηλεκτραρνητικότητα Στοιχείων
Όταν εξετάζουμε μια περίοδο στον περιοδικό πίνακα, το ατομικό μέγεθος κάθε στοιχείου μειώνεται από τα αριστερά προς τα δεξιά της περιόδου. Αυτό συμβαίνει επειδή ο αριθμός των ηλεκτρονίων που υπάρχουν στο φλοιό σθένους και ο αριθμός των πρωτονίων στον πυρήνα αυξάνονται, και έτσι, η έλξη μεταξύ των ηλεκτρονίων και του πυρήνα αυξάνεται σταδιακά. Επομένως, η ηλεκτραρνητικότητα αυξάνεται επίσης κατά την ίδια περίοδο επειδή αυξάνεται η έλξη που προέρχεται από τον πυρήνα. Τότε τα άτομα μπορούν εύκολα να προσελκύσουν ηλεκτρόνια από το εξωτερικό.
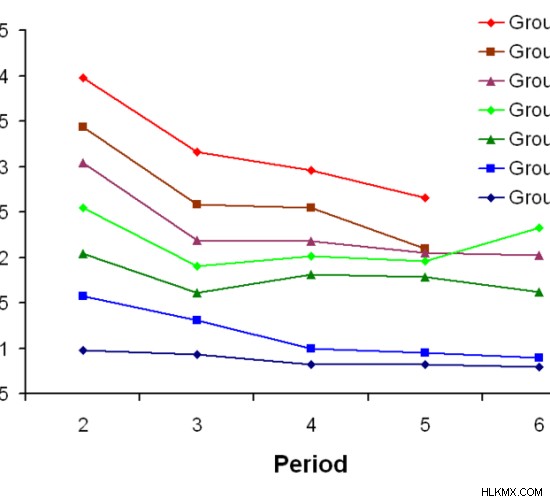
Εικόνα 02:Ηλεκτραρνητικότητα (XP) από πάνω προς τα κάτω κάθε ομάδας
Η ομάδα 17 έχει τα μικρότερα άτομα κάθε περιόδου, επομένως έχει την υψηλότερη ηλεκτραρνητικότητα. Αλλά η ηλεκτραρνητικότητα μειώνεται στην ομάδα επειδή το ατομικό μέγεθος αυξάνεται προς τα κάτω στην ομάδα λόγω της αύξησης του αριθμού των τροχιακών.
Τι είναι η συγγένεια ηλεκτρονίων
Η συγγένεια ηλεκτρονίων είναι η ποσότητα ενέργειας που απελευθερώνεται όταν ένα ουδέτερο άτομο ή μόριο (στην αέρια φάση) αποκτά ένα ηλεκτρόνιο από το εξωτερικό. Αυτή η προσθήκη ηλεκτρονίων προκαλεί το σχηματισμό ενός αρνητικά φορτισμένου χημικού είδους. Αυτό μπορεί να αναπαρασταθεί με σύμβολα ως εξής.
X + e → X + ενέργεια
Η προσθήκη ενός ηλεκτρονίου σε ένα ουδέτερο άτομο ή ένα μόριο απελευθερώνει ενέργεια. Αυτό ονομάζεται εξώθερμη αντίδραση . Αυτή η αντίδραση οδηγεί σε ένα αρνητικό ιόν. Αλλά εάν ένα άλλο ηλεκτρόνιο πρόκειται να προστεθεί σε αυτό το αρνητικό ιόν, θα πρέπει να δοθεί ενέργεια για να προχωρήσουμε σε αυτήν την αντίδραση. Αυτό συμβαίνει επειδή το εισερχόμενο ηλεκτρόνιο απωθείται από τα άλλα ηλεκτρόνια. Αυτό το φαινόμενο ονομάζεται ενδόθερμη αντίδραση .
Επομένως, οι πρώτες συγγένειες ηλεκτρονίων είναι αρνητικές τιμές και οι δεύτερες τιμές συγγένειας ηλεκτρονίων του ίδιου είδους είναι θετικές τιμές.
Συγγένεια πρώτου ηλεκτρονίου: X(g) + e → X(g)
Συγγένεια δεύτερου ηλεκτρονίου: X(g) + e → X(g)
Όπως η ηλεκτραρνητικότητα, η συγγένεια ηλεκτρονίων εμφανίζει επίσης περιοδικές διακυμάνσεις στον περιοδικό πίνακα. Αυτό συμβαίνει επειδή το εισερχόμενο ηλεκτρόνιο προστίθεται στο εξώτατο τροχιακό ενός ατόμου. Τα στοιχεία του περιοδικού πίνακα είναι διατεταγμένα σύμφωνα με την αύξουσα σειρά του ατομικού τους αριθμού. Όταν αυξάνεται ο ατομικός αριθμός, αυξάνεται ο αριθμός των ηλεκτρονίων που έχουν στα εξωτερικά τροχιακά τους.
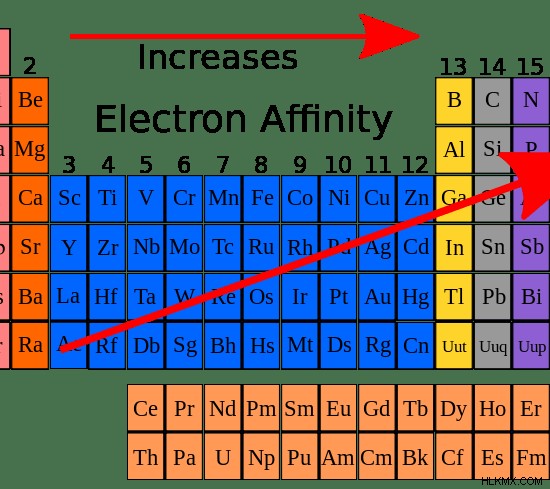
Εικόνα 3:Το γενικό μοτίβο της αύξησης της συγγένειας των ηλεκτρονίων κατά τη διάρκεια μιας περιόδου
Γενικά, η συγγένεια ηλεκτρονίων θα πρέπει να αυξάνεται κατά την περίοδο από αριστερά προς τα δεξιά, επειδή ο αριθμός των ηλεκτρονίων αυξάνεται κατά τη διάρκεια μιας περιόδου. Έτσι, είναι δύσκολο να προστεθεί ένα νέο ηλεκτρόνιο. Όταν αναλύονται πειραματικά, οι τιμές συγγένειας ηλεκτρονίων δείχνουν ένα μοτίβο ζιγκ-ζαγκ και όχι ένα μοτίβο που δείχνει μια σταδιακή αύξηση.
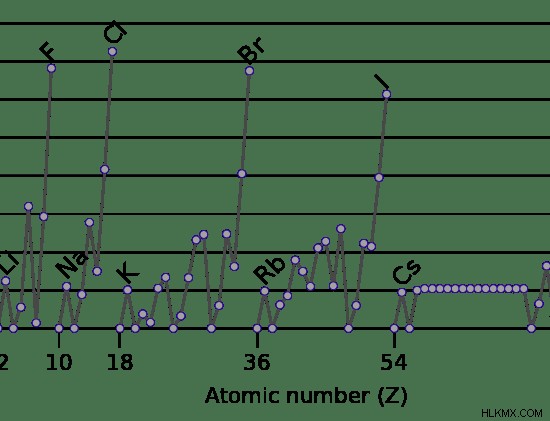
Εικόνα 4:Παραλλαγές της συγγένειας των στοιχείων ηλεκτρονίων
Η παραπάνω εικόνα δείχνει ότι η περίοδος που ξεκινά από το λίθιο (Li) δείχνει ένα ποικίλο μοτίβο και όχι μια σταδιακή αύξηση της συγγένειας ηλεκτρονίων. Το βηρύλλιο (Be) έρχεται μετά το λίθιο (Li) στον περιοδικό πίνακα, αλλά η συγγένεια ηλεκτρονίων του βηρυλλίου είναι χαμηλότερη από το λίθιο. Αυτό συμβαίνει επειδή το εισερχόμενο ηλεκτρόνιο μεταφέρεται στο τροχιακό s του λιθίου όπου υπάρχει ήδη ένα μόνο ηλεκτρόνιο. Αυτό το ηλεκτρόνιο μπορεί να απωθήσει το εισερχόμενο ηλεκτρόνιο, με αποτέλεσμα μια υψηλή συγγένεια ηλεκτρονίων. Αλλά στο Βηρύλλιο, το εισερχόμενο ηλεκτρόνιο γεμίζει σε ένα ελεύθερο τροχιακό p όπου δεν υπάρχει απώθηση. Επομένως, η συγγένεια ηλεκτρονίων έχει ελαφρώς μικρότερη τιμή.
Διαφορά μεταξύ ηλεκτροαρνητικότητας και συγγένειας ηλεκτρονίων
Ορισμός
Ηλεκτραρνητικότητα: Η ηλεκτροαρνητικότητα είναι η ικανότητα ενός ατόμου να έλκει ηλεκτρόνια από το εξωτερικό.
Συγγένεια ηλεκτρονίων: Η συγγένεια ηλεκτρονίων είναι η ποσότητα ενέργειας που απελευθερώνεται όταν ένα ουδέτερο άτομο ή μόριο (στην αέρια φάση) αποκτά ένα ηλεκτρόνιο από το εξωτερικό.
Φύση
Ηλεκτραρνητικότητα: Η ηλεκτροαρνητικότητα είναι μια ποιοτική ιδιότητα όπου χρησιμοποιείται μια κλίμακα για τη σύγκριση της ιδιότητας.
Συγγένεια ηλεκτρονίων: Η συγγένεια ηλεκτρονίων είναι μια ποσοτική μέτρηση.
Μονάδες μέτρησης
Ηλεκτραρνητικότητα: Η ηλεκτροαρνητικότητα μετριέται από τις μονάδες Pauling.
Συγγένεια ηλεκτρονίων: Η συγγένεια ηλεκτρονίων μετράται είτε από eV είτε από kj/mol.
Εφαρμογή
Ηλεκτραρνητικότητα: Η ηλεκτροαρνητικότητα εφαρμόζεται για ένα μόνο άτομο.
Συγγένεια ηλεκτρονίων: Η συγγένεια ηλεκτρονίων μπορεί να εφαρμοστεί είτε για ένα άτομο είτε για ένα μόριο.
Συμπέρασμα
Η κύρια διαφορά μεταξύ ηλεκτραρνητικότητας και συγγένειας ηλεκτρονίων είναι ότι η ηλεκτραρνητικότητα είναι η ικανότητα ενός ατόμου να έλκει ηλεκτρόνια από το εξωτερικό, ενώ η συγγένεια ηλεκτρονίων είναι η ποσότητα ενέργειας που απελευθερώνεται όταν ένα άτομο αποκτά ηλεκτρόνιο.