Διαφορά μεταξύ πλήρους καύσης και ατελούς καύσης
Κύρια διαφορά – Πλήρης καύση έναντι ατελούς καύσης
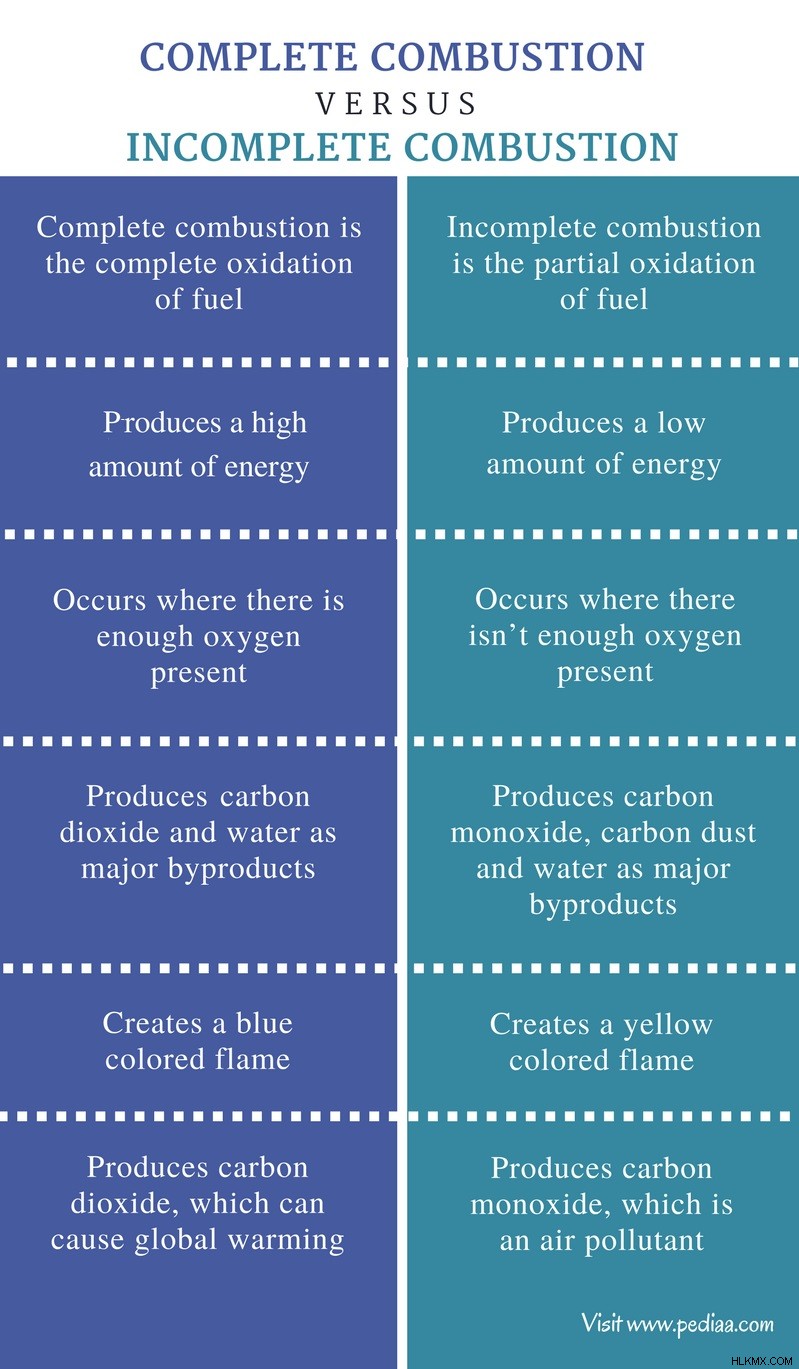
Η αντίδραση καύσης είναι μια χημική αντίδραση που απελευθερώνει ενέργεια από την οξείδωση ενός καυσίμου. Οι χημικές αντιδράσεις που απελευθερώνουν ενέργεια ονομάζονται εξώθερμες αντιδράσεις. Έτσι, οι αντιδράσεις καύσης είναι εξώθερμες. Ένα καύσιμο μπορεί να οξειδωθεί με έναν οξειδωτικό παράγοντα. Ο οξειδωτικός παράγοντας για τις περισσότερες αντιδράσεις καύσης είναι το ατμοσφαιρικό οξυγόνο. Η ενέργεια που απελευθερώνεται από τις αντιδράσεις καύσης μπορεί να είναι είτε θερμότητα είτε φως. Η ενέργεια απελευθερώνεται κυρίως με τη μορφή θερμότητας. Η φωτεινή ενέργεια απελευθερώνεται επίσης ως φλόγα. Η καύση μπορεί να συμβεί με δύο τρόπους, όπως η πλήρης και η ατελής καύση. Η κύρια διαφορά μεταξύ της πλήρους καύσης και της ατελούς καύσης είναι ότι στην πλήρη καύση, το διοξείδιο του άνθρακα είναι το μόνο προϊόν που περιλαμβάνει άνθρακα, ενώ, στην ατελή καύση, το μονοξείδιο του άνθρακα και η σκόνη του άνθρακα σχηματίζονται ως προϊόντα.
Σχηματίστηκαν βασικές περιοχές
1. Τι είναι Πλήρης Καύση
– Ορισμός, Ιδιότητες, Παραδείγματα
2. Τι είναι η Ατελής Καύση
– Ορισμός, Ιδιότητες, Παραδείγματα
3. Ποιες είναι οι ομοιότητες μεταξύ της πλήρους καύσης και της ατελούς καύσης
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά μεταξύ της πλήρους καύσης και της ατελούς καύσης
– Σύγκριση βασικών διαφορών
Βασικοί όροι:διοξείδιο του άνθρακα, μονοξείδιο του άνθρακα, καύση, εξώθερμη αντίδραση, φλόγα, καύσιμο, οξείδωση, οξειδωτικός παράγοντας
Τι είναι η Πλήρης Καύση
Η πλήρης καύση είναι η πλήρης οξείδωση του καυσίμου. Αυτή η αντίδραση είναι εξαιρετικά εξώθερμη και παράγει μεγάλη ποσότητα ενέργειας και περιορισμένο αριθμό προϊόντων. Κατά την καύση ή την καύση καυσίμου, οι υδρογονάνθρακες στο καύσιμο οξειδώνονται από το ατμοσφαιρικό οξυγόνο, δίνοντας διοξείδιο του άνθρακα (CO2 ) και νερό (H2 Ο) ως προϊόντα. Η πλήρης καύση λαμβάνει χώρα όπου υπάρχει επαρκής ποσότητα οξυγόνου. Παρουσία οξυγόνου, τα άτομα άνθρακα στους υδρογονάνθρακες μπορούν να οξειδωθούν σε διοξείδιο του άνθρακα και το υδρογόνο οξειδώνεται σε νερό. Η γενική αντίδραση για την πλήρη καύση δίνεται παρακάτω.
Υδρογονάνθρακας + Οξυγόνο → Διοξείδιο του άνθρακα + Νερό
Για ένα καύσιμο όπως η αιθανόλη, η πλήρης καύση μπορεί να δοθεί ως,
C2 H5 OH(l) + 3O2(g) → 2CO2(g) + 3H2 O(l)
Οι αντιδράσεις πλήρους καύσης έχουν ως αποτέλεσμα οξείδια του άνθρακα, του θείου και άλλων στοιχείων που υπάρχουν στο καύσιμο. Ο άνθρακας οξειδώνεται σε διοξείδιο του άνθρακα ενώ το θείο οξειδώνεται σε διοξείδιο του θείου. Η πλήρης καύση έχει ως αποτέλεσμα μικρότερη ποσότητα ατμοσφαιρικών ρύπων. Η πλήρης καύση μπορεί γενικά να χαρακτηριστεί από μπλε φλόγα.

Εικόνα 01:Μια μπλε φλόγα δημιουργείται σε πλήρη καύση.
Δεδομένου ότι η ατμόσφαιρα αποτελείται μόνο από 21% κατ' όγκο οξυγόνο, απαιτείται πολύς αέρας για να πραγματοποιηθεί η πλήρης καύση. Παρόλο που η ποσότητα των παραπροϊόντων που προκύπτουν από την πλήρη καύση είναι χαμηλή, εξακολουθεί να προσθέτει δυσμενείς εκπομπές. Για παράδειγμα, το διοξείδιο του άνθρακα είναι ένα αέριο του θερμοκηπίου που προκαλεί υπερθέρμανση του πλανήτη.
Τι είναι η Ατελής Καύση
Η ατελής καύση είναι μια χημική αντίδραση που περιλαμβάνει τη μερική οξείδωση ενός καυσίμου. Η ατελής καύση συμβαίνει όπου δεν υπάρχει ανεπαρκής ποσότητα οξυγόνου. Εδώ, το καύσιμο είναι ατελώς οξειδωμένο. Ως εκ τούτου, η ατελής καύση σχηματίζει έναν αριθμό υποπροϊόντων. Αλλά η ποσότητα ενέργειας που απελευθερώνεται από αυτή την καύση είναι συγκριτικά χαμηλή. Τα κύρια προϊόντα της ατελούς καύσης περιλαμβάνουν το μονοξείδιο του άνθρακα (CO), τη σκόνη του άνθρακα (την ονομάζουμε αιθάλη) και το νερό (H2 Ο). Ο γενικός τύπος για την ατελή καύση φαίνεται παρακάτω.
Υδρογονάνθρακας + Οξυγόνο → Μονοξείδιο του άνθρακα + Άνθρακας + Νερό
Τα υποπροϊόντα ενδέχεται να διαφέρουν ανάλογα με την ποσότητα οξυγόνου που εμπλέκεται στην καύση. Για παράδειγμα, μερικές φορές αποδίδει μόνο μονοξείδιο του άνθρακα ή αιθάλη. Ωστόσο, συνήθως δίνει ένα μείγμα μονοξειδίου του άνθρακα και αιθάλης μαζί με νερό.
Για παράδειγμα, η ατελής καύση του αιθυλενίου μπορεί να οδηγήσει σε άνθρακα και νερό ως υποπροϊόντα.
C2 H4(l) + O2(g) → 2C(ες) + 2H2 O(g)
Η ατελής καύση της αιθανόλης μπορεί να σχηματίσει μονοξείδιο του άνθρακα και σκόνη άνθρακα μαζί με νερό.
C2 H5 OH(l) + 2O2(g) → 2CO(g) + 3H2 O(l)
C2 H5 OH(l) + O2(g) → C(ες) + 3H2 O(l)

Εικόνα 2:Παράγεται μια κίτρινη φλόγα με ατελή καύση.
Η ατελής καύση χαρακτηρίζεται από κίτρινη φλόγα. Δεδομένου ότι η ποσότητα ενέργειας που απελευθερώνεται από την ατελή καύση είναι χαμηλή, είναι ανεπιθύμητη. Επιπλέον, το μονοξείδιο του άνθρακα που παράγεται από αυτή την καύση είναι ατμοσφαιρικός ρύπος και είναι θανατηφόρος για τον ανθρώπινο οργανισμό. Το μονοξείδιο του άνθρακα μπορεί να συνδεθεί με την αιμοσφαιρίνη στο αίμα μας και να περιορίσει τη μεταφορά οξυγόνου μέσα στο σώμα.
Ομοιότητες μεταξύ πλήρους καύσης και ατελούς καύσης
- Τόσο η πλήρης όσο και η ατελής καύση είναι εξώθερμες.
- Παράγουν θερμότητα και φως ως μορφές ενέργειας.
- Και οι δύο αντιδράσεις δίνουν νερό ως υποπροϊόν.
- Και οι δύο τύποι καύσης περιλαμβάνουν την οξείδωση ενός καυσίμου.
- Αυτές οι αντιδράσεις περιλαμβάνουν το συνδυασμό μοριακού οξυγόνου με καύσιμο.
- Και οι δύο αυτές αντιδράσεις καύσης έχουν ως αποτέλεσμα δυσμενείς εκπομπές αερίων.
- Μπορούν να σχηματίσουν φλόγες ενώ καίγονται.
Διαφορά μεταξύ πλήρους καύσης και ατελούς καύσης
Ορισμός
Πλήρης καύση: Η πλήρης καύση είναι η πλήρης οξείδωση του καυσίμου.
Ημιτελής καύση: Η ατελής καύση είναι η μερική οξείδωση του καυσίμου.
Απελευθερώθηκε ενέργεια
Πλήρης καύση: Η πλήρης καύση παράγει μεγάλη ποσότητα ενέργειας.
Ημιτελής καύση: Η ατελής καύση παράγει χαμηλή ποσότητα ενέργειας.
Ποσότητα οξυγόνου που εμπλέκεται
Πλήρης καύση: Η πλήρης καύση λαμβάνει χώρα όπου υπάρχει αρκετό οξυγόνο.
Ημιτελής καύση: Η ατελής καύση συμβαίνει όπου δεν υπάρχει αρκετό οξυγόνο.
Υποπροϊόντα
Πλήρης καύση: Η πλήρης καύση παράγει διοξείδιο του άνθρακα και νερό ως κύρια υποπροϊόντα.
Ημιτελής καύση: Η ατελής καύση παράγει μονοξείδιο του άνθρακα, σκόνη του άνθρακα και νερό ως κύρια υποπροϊόντα.
Φλόγα
Πλήρης καύση: Η πλήρης καύση δημιουργεί μια μπλε φλόγα.
Ημιτελής καύση: Η ατελής καύση δημιουργεί μια κίτρινη φλόγα.
Επίδραση στο περιβάλλον
Πλήρης καύση: Η πλήρης καύση παράγει διοξείδιο του άνθρακα που μπορεί να προκαλέσει υπερθέρμανση του πλανήτη.
Ημιτελής καύση: Η ατελής καύση παράγει μονοξείδιο του άνθρακα που είναι ατμοσφαιρικός ρύπος.
Συμπέρασμα
Οι αντιδράσεις καύσης είναι εξώθερμες αντιδράσεις που απελευθερώνουν ενέργεια όταν καίγεται καύσιμο. Η πλήρης καύση ενός καυσίμου αποδίδει υψηλή ποσότητα ενέργειας ενώ η ατελής καύση αποδίδει λιγότερη ποσότητα ενέργειας. Αυτή είναι η κύρια διαφορά μεταξύ της πλήρους καύσης και της ατελούς καύσης. Η πλήρης καύση είναι πολύ σημαντική σε εφαρμογές βιομηχανικής κλίμακας. Η ατελής καύση χρησιμοποιείται σε οικιακές ανάγκες, όπως η καύση ξύλου για την παραγωγή θερμικής ενέργειας για το μαγείρεμα, κ.λπ. Παρόλο που υπάρχουν πολλές χρήσεις στην καύση, προκαλεί την εκπομπή δυσμενών αερίων στο περιβάλλον που μπορούν να λειτουργήσουν ως ατμοσφαιρικοί ρύποι.