Διαφορά μεταξύ φθοριούχου νατρίου και φθορίου
Κύρια διαφορά – Φθοριούχο νάτριο έναντι Φθόριο
Το φθοριούχο νάτριο είναι μια χημική ένωση. Το φθόριο είναι ένα ανιόν. Αυτά τα δύο χημικά είδη είναι πολύ σημαντικά σε διαφορετικές εφαρμογές. Για παράδειγμα, το φθοριούχο νάτριο χρησιμοποιείται ως φάρμακο. Όταν εξετάζουμε τη χημική δομή του φθοριούχου νατρίου, αποτελείται από κατιόντα νατρίου και ανιόντα φθορίου. Επομένως, το φθοριούχο νάτριο είναι μια καλή πηγή ανιόντων φθορίου. Μερικές φορές, ο όρος φθόριο χρησιμοποιείται για να περιγράψει οποιαδήποτε ένωση που αποτελείται από κατιόν μετάλλου και ανιόν φθορίου. Με άλλα λόγια, τα φθορίδια μετάλλων είναι γνωστά ως φθορίδια σε γενική χρήση. Ωστόσο, ο όρος φθόριο χρησιμοποιείται στην πραγματικότητα για το ανιόν. Η κύρια διαφορά μεταξύ του φθοριούχου νατρίου και του φθορίου είναι ότι το φθοριούχο νάτριο είναι μια ουδέτερη ένωση ενώ το φθόριο είναι ένα ανιόν.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το φθοριούχο νάτριο
– Ορισμός, ιδιότητες και αντιδράσεις
2. Τι είναι το Φθόριο
– Ορισμός, ιδιότητες και αντιδράσεις
3. Ποια είναι η διαφορά μεταξύ του φθοριούχου νατρίου και του φθορίου
– Σύγκριση βασικών διαφορών
Βασικοί όροι:ανιόν, φθόριο, φθοριούχο νάτριο (NaF) 
Τι είναι το φθοριούχο νάτριο
Το φθοριούχο νάτριο είναι μια ιοντική ένωση που αποτελείται από ιόντα Na και ιόντα F. Ο χημικός τύπος του φθοριούχου νατρίου δίνεται ως NaF . Η μοριακή μάζα του φθοριούχου νατρίου είναι περίπου 42 g/mol. Εμφανίζεται ως πρασινωπό λευκό στερεό σε θερμοκρασία δωματίου. Το φθοριούχο νάτριο είναι μια άοσμη ένωση. Δεδομένου ότι είναι μια ιοντική ένωση, το σημείο τήξης και το σημείο βρασμού είναι πολύ υψηλά. Το σημείο τήξης του φθοριούχου νατρίου είναι 993 C. Το σημείο βρασμού είναι περίπου 1700C. Όταν το στερεό φθοριούχο νάτριο θερμαίνεται, σχηματίζει ένα τοξικό αέριο:υδροφθόριο (HF).
Το φθοριούχο νάτριο βρίσκεται φυσικά σε ένα σπάνιο ορυκτό που ονομάζεται Villiaumite σε μικρές ποσότητες. Ως εκ τούτου, η βιομηχανική παραγωγή είναι η κύρια πηγή του φθοριούχου νατρίου. Συνήθως παρασκευάζεται με την αντίδραση μεταξύ υδροφθορικού οξέος και μιας βάσης όπως το υδροξείδιο του νατρίου.
HF + NaOH → NaF + H2 O
Το φθοριούχο νάτριο είναι διαλυτό στο νερό. Όταν διαλυθεί στο νερό, δίνει υδατικά ιόντα νατρίου και ιόντα φθορίου. Επομένως, τα υδατικά διαλύματα φθοριούχου νατρίου μπορούν να μεταφέρουν ηλεκτρισμό. Τα ιόντα στο διάλυμα προκαλούν την αγωγιμότητα του διαλύματος. Δεδομένου ότι το φθοριούχο νάτριο είναι άλας νατρίου, έχει αλμυρή γεύση.
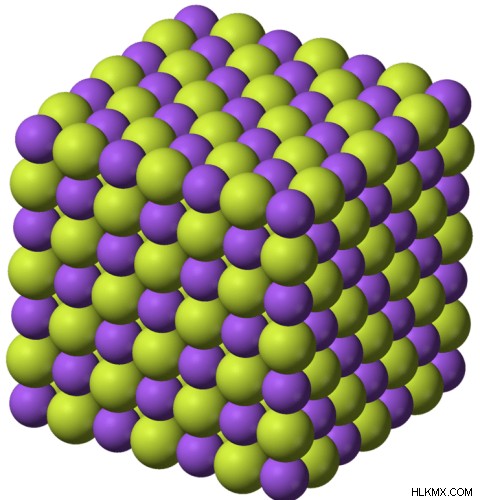
Εικόνα 1:Το NaF είναι μια ιοντική ένωση
Το φθοριούχο νάτριο είναι ένα φάρμακο που χρησιμοποιείται για την πρόληψη της τερηδόνας στα δόντια. Κάνει τα δόντια πιο δυνατά και ανθεκτικά στην τερηδόνα από βακτηριακές δραστηριότητες. Ως εκ τούτου, η οδοντόκρεμα συχνά αποτελείται από φθοριούχο νάτριο. Ωστόσο, οι υπερβολικές ποσότητες φθοριούχου νατρίου προκαλούν τα δόντια να κιτρινίζουν. Επιπλέον, το φθοριούχο νάτριο είναι καλό καθαριστικό.
Τι είναι το φθόριο
Το φθόριο είναι ένα ανόργανο ανιόν. Σχηματίζεται από το στοιχείο φθόριο. Το χημικό σύμβολο για το φθόριο είναι το F. Η μοριακή μάζα είναι περίπου 19 g/mol. Τα άτομα φθορίου αποτελούνται από 7 ηλεκτρόνια στα εξωτερικά τροχιακά τους. Επομένως, τους λείπει ένα ηλεκτρόνιο για να λάβουν μια σταθερή ηλεκτρονική διαμόρφωση (αν υπάρχουν 8 ηλεκτρόνια στο εξώτατο τροχιακό ενός ατόμου, είναι πολύ σταθερό). Όταν ένα ηλεκτρόνιο λαμβάνεται από έξω, δεν υπάρχουν αρκετά θετικά φορτία στον πυρήνα για να εξουδετερώσουν το εισερχόμενο ηλεκτρόνιο. Ως εκ τούτου, σχηματίζει ένα ανιόν με -1 ηλεκτρικό φορτίο. Αυτό το ανιόν είναι το ιόν φθορίου.
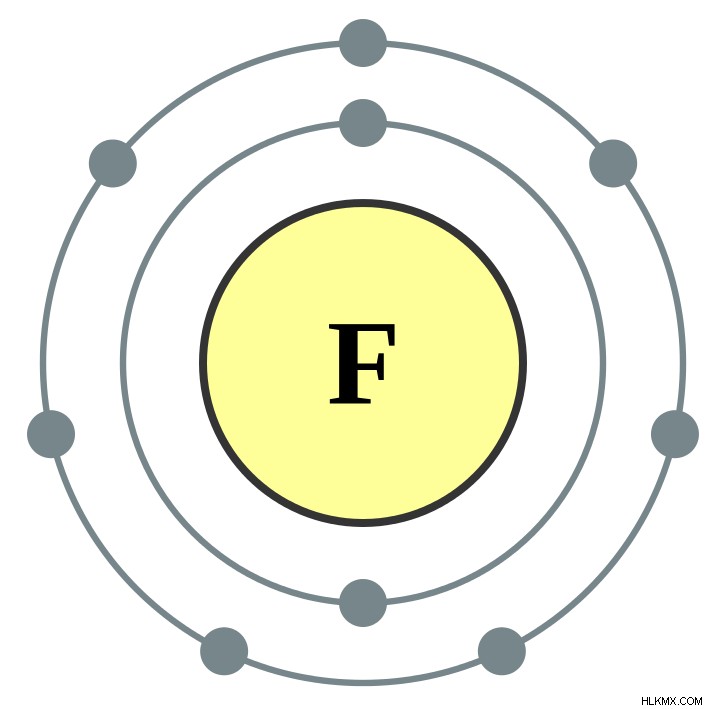
Εικόνα 2:Το άτομο φθορίου χρειάζεται ένα ακόμη ηλεκτρόνιο για να γεμίσει το εξώτατο τροχιακό του.
Τα ιόντα φθορίου μπορούν να βρεθούν ως συστατικό σε ορισμένα ορυκτά. Για παράδειγμα, ο φθορίτης αποτελείται από CaF2 μονάδες. Υπάρχουν ιόντα φθορίου σε συνδυασμό με ιόντα ασβεστίου.
Τα ιόντα φθορίου μερικές φορές αντιδρούν ως βάση. Στη συνέχεια μπορεί να συνδυαστεί με το Η δίνοντας ηλεκτρόνια σε άτομα υδρογόνου. Η αντίδραση μεταξύ νερού και ιόντων φθορίου παράγει υδροφθόριο (HF). Αυτή είναι μια αναστρέψιμη αντίδραση.
Καθώς τα ιόντα φθορίου είναι καλά για τα δόντια, τα φυτά νερού προσθέτουν κάποια ποσότητα ιόντων φθορίου στο νερό.
Διαφορά μεταξύ φθοριούχου νατρίου και φθορίου
Ορισμός
Φθοριούχο νάτριο: Το φθοριούχο νάτριο είναι μια ιοντική ένωση που αποτελείται από ιόντα Na και ιόντα F.
Φθόριο: Το φθόριο είναι ένα ανόργανο ανιόν.
Ηλεκτρική φόρτιση
Φθοριούχο νάτριο: Το φθοριούχο νάτριο είναι μια ουδέτερη ένωση.
Φθόριο: Τα ιόντα φθορίου είναι αρνητικά φορτισμένες ενώσεις.
Μοριακή μάζα
Φθοριούχο νάτριο: Η μοριακή μάζα του φθοριούχου νατρίου είναι περίπου 42 g/mol.
Φθόριο: Η μοριακή μάζα του φθορίου είναι περίπου 19 g/mol.
Βασικές μονάδες
Φθοριούχο νάτριο: Μία μονάδα ένωσης φθοριούχου νατρίου αποτελείται από ένα ιόν Na και ένα ιόν F.
Φθόριο: Μία μονάδα φθορίου αποτελείται από ιόν F.
Συμπέρασμα
Τα φθόριο είναι πολύ σημαντικά συστατικά στην καθημερινή μας διατροφή, καθώς τα ιόντα φθορίου είναι ένα καλό φάρμακο για υγιή δόντια. Καθώς η ποσότητα φθορίου που υπάρχει στα τρόφιμα που καταναλώνουμε καθημερινά είναι μικρή, ιόντα φθορίου προστίθενται στο νερό. Έτσι, το πόσιμο νερό αποτελείται από ιόντα φθορίου. Το φθοριούχο νάτριο χρησιμοποιείται στην παραγωγή οδοντόκρεμας. Η κύρια διαφορά μεταξύ του φθοριούχου νατρίου και του φθοριούχου είναι ότι το φθοριούχο νάτριο είναι μια ουδέτερη ένωση ενώ το φθόριο είναι ένα ανιόν.




