Διαφορά μεταξύ ζεύγους ομολόγων και μοναχικού ζεύγους
Κύρια διαφορά – Ζεύγος ομολόγων έναντι μοναχικού ζεύγους
Κάθε στοιχείο έχει ηλεκτρόνια στα άτομά του. Αυτά τα ηλεκτρόνια βρίσκονται σε κελύφη που βρίσκονται έξω από τον πυρήνα. Ένα κέλυφος μπορεί να έχει ένα ή περισσότερα τροχιακά. Τα τροχιακά που βρίσκονται πιο κοντά στον πυρήνα είναι τα s, p και d τροχιακά. Ένα τροχιακό μπορεί να χωριστεί σε πολλά υπο-τροχιακά. Ένα υπο-τροχιακό μπορεί να χωρέσει το πολύ δύο ηλεκτρόνια. Όταν δεν υπάρχουν ηλεκτρόνια, ονομάζεται κενό τροχιακό. Όταν υπάρχει ένα ηλεκτρόνιο σε ένα υποτροχιακό, αυτό ονομάζεται ασύζευκτο ηλεκτρόνιο. Όταν το υποτροχιακό είναι γεμάτο με δύο ηλεκτρόνια το πολύ, ονομάζεται ζεύγος ηλεκτρονίων. Τα ζεύγη ηλεκτρονίων μπορούν να βρεθούν σε δύο τύπους ως ζεύγος δεσμών και μοναχικό ζεύγος. Η κύρια διαφορά μεταξύ ζεύγους δεσμών και μοναχικού ζεύγους είναι ότι το ζεύγος δεσμών αποτελείται από δύο ηλεκτρόνια που βρίσκονται σε έναν δεσμό ενώ το μοναχικό ζεύγος αποτελείται από δύο ηλεκτρόνια που δεν βρίσκονται σε δεσμό.
Βασικές περιοχές που καλύπτονται
1. Τι είναι ένα ζεύγος ομολόγων
– Ορισμός, Ταυτοποίηση, Παραδείγματα
2. Τι είναι ένα μοναχικό ζευγάρι
– Ορισμός, Ταυτοποίηση, Παραδείγματα
3. Ποια είναι η διαφορά μεταξύ Bond Pair και Lone Pair
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ζεύγος δεσμών, ομοιοπολικός δεσμός, διπλός δεσμός, μοναχικό ζεύγος, μη δεσμευτικό ζεύγος ηλεκτρονίων, τροχιακό, δεσμός pi, δεσμός σίγμα, απλός δεσμός, ασύζευκτα ηλεκτρόνια, ηλεκτρόνια σθένους 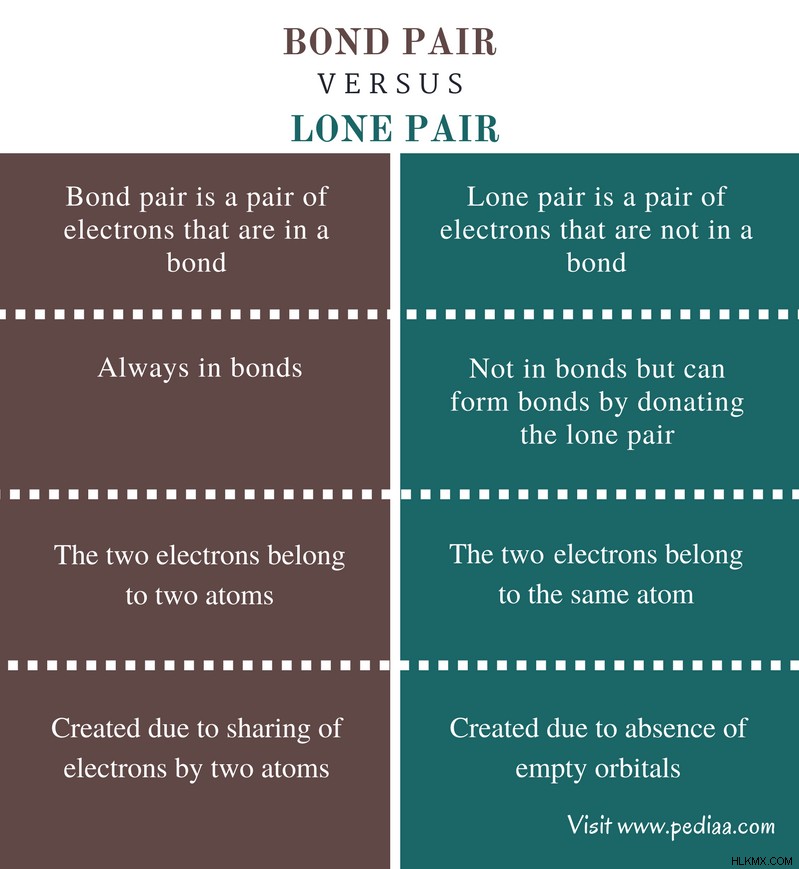
Τι είναι ένα ζεύγος ομολόγων
Ένα ζεύγος δεσμών είναι ένα ζεύγος ηλεκτρονίων που βρίσκονται σε δεσμό. Ένας απλός δεσμός αποτελείται πάντα από δύο ηλεκτρόνια που είναι ζευγαρωμένα μεταξύ τους. Αυτά τα δύο ηλεκτρόνια μαζί ονομάζονται ζεύγος δεσμών. Τα ζεύγη δεσμών μπορούν να φανούν σε ομοιοπολικές ενώσεις και ενώσεις συντονισμού. Στις ομοιοπολικές ενώσεις, ο ομοιοπολικός δεσμός αποτελείται από ένα ζεύγος δεσμών. Στις ενώσεις συντονισμού, ο δεσμός συντονισμού αποτελείται από ένα ζεύγος δεσμών.
Στις ενώσεις συντονισμού, οι συνδέτες δωρίζουν τα μόνα τους ζεύγη ηλεκτρονίων σε ένα κεντρικό άτομο μετάλλου. Αν και ήταν μοναχικά ζευγάρια, σχηματίζουν δεσμούς συντονισμού που είναι παρόμοιοι με τον ομοιοπολικό δεσμό μετά τη δωρεά. ως εκ τούτου θεωρούνται ως ζεύγος ομολόγων. Αυτό συμβαίνει επειδή τα δύο ηλεκτρόνια μοιράζονται μεταξύ δύο ατόμων.
Στις ομοιοπολικές ενώσεις, δύο άτομα μοιράζονται τα ασύζευκτα ηλεκτρόνια τους για να τα κάνουν ζευγαρωμένα. Αυτό το ζεύγος ηλεκτρονίων ονομάζεται ζεύγος δεσμών. Όταν υπάρχουν διπλοί ή τριπλοί δεσμοί, υπάρχουν ζεύγη δεσμών ανά κάθε δεσμό. Για παράδειγμα, εάν υπάρχει διπλός δεσμός, υπάρχουν δύο ζεύγη δεσμών. Δεδομένου ότι ένας ομοιοπολικός δεσμός σχηματίζεται μέσω του υβριδισμού τροχιακών δύο ατόμων, ένα ζεύγος δεσμών βρίσκεται σε υβριδισμένα τροχιακά. Αυτά τα υβριδισμένα τροχιακά μπορούν να σχηματίσουν είτε δεσμούς σίγμα είτε δεσμούς π. Επομένως τα ζεύγη δεσμών μπορούν να παρατηρηθούν είτε σε δεσμούς σίγμα είτε σε δεσμούς π.
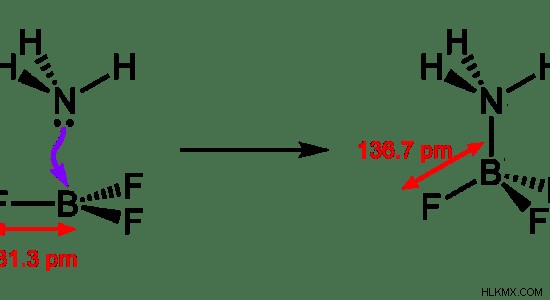
Εικόνα 1:Ο δεσμός συντονισμού μεταξύ NH3 και BF3
Στο παραπάνω παράδειγμα, το ζεύγος ηλεκτρονίων στο άτομο Ν του μορίου NH3 δίνεται στο άτομο Β του μορίου BF3. Στη συνέχεια, ο δεσμός συντονισμού μοιάζει με ομοιοπολικό δεσμό. Επομένως, το ζεύγος ηλεκτρονίων είναι πλέον ένα ζεύγος δεσμών.
Τι είναι το Lone Pair
Το μοναχικό ζεύγος είναι ένα ζεύγος ηλεκτρονίων που δεν βρίσκονται σε δεσμό. Τα ηλεκτρόνια του μοναχικού ζεύγους ανήκουν στο ίδιο άτομο. Επομένως, ένα μοναχικό ζεύγος ονομάζεται επίσης ζεύγος ηλεκτρονίων που δεν δεσμεύεται . Αν και τα ηλεκτρόνια στα εσωτερικά κελύφη είναι επίσης συζευγμένα και δεν συμμετέχουν στη σύνδεση, δεν θεωρούνται ως μόνα ζεύγη. Τα ηλεκτρόνια σθένους ενός ατόμου που είναι συζευγμένα μεταξύ τους θεωρούνται ως μόνα ζεύγη.
Μερικές φορές αυτά τα μεμονωμένα ζεύγη μπορούν να δωριστούν σε άλλο άτομο που έχει κενά τροχιακά. Τότε σχηματίζει έναν δεσμό συντονισμού. Στη συνέχεια, δεν θεωρείται ως μοναχικό ζευγάρι αφού γίνεται ζεύγος ομολόγων. Ορισμένα στοιχεία έχουν μόνο ένα μοναχικό ζευγάρι. Ορισμένα άλλα στοιχεία έχουν περισσότερα από ένα μοναχικά ζευγάρια. Για παράδειγμα, το άζωτο (Ν) μπορεί να σχηματίσει το πολύ τρεις ομοιοπολικούς δεσμούς. Αλλά ο αριθμός των ηλεκτρονίων σθένους που έχει είναι 5. Επομένως, τρία ηλεκτρόνια μοιράζονται με άλλα άτομα για να σχηματίσουν δεσμούς, ενώ άλλα δύο ηλεκτρόνια παραμένουν ως ένα μοναχικό ζεύγος. Όμως τα αλογόνα έχουν 7 ηλεκτρόνια στο εξώτατο τροχιακό τους. Επομένως, έχουν 3 μόνα ζεύγη μαζί με ένα ασύζευκτο ηλεκτρόνιο. Επομένως, τα αλογόνα μπορούν να έχουν έναν ομοιοπολικό δεσμό μοιράζοντας αυτό το ένα ασύζευκτο ηλεκτρόνιο.
Τα μεμονωμένα ζεύγη αλλάζουν τη γωνία των δεσμών σε ένα μόριο. Για παράδειγμα, θεωρήστε ένα γραμμικό μόριο που αποτελείται από ένα κεντρικό άτομο που έχει δύο δεσμούς. Εάν δεν υπάρχουν μόνα ζεύγη, το μόριο θα παραμείνει ως γραμμικό μόριο. Αλλά αν υπάρχουν ένα ή περισσότερα μεμονωμένα ζεύγη στο κεντρικό άτομο, το μόριο δεν θα είναι πλέον γραμμικό. Λόγω της απώθησης που προκαλούν τα μοναχικά ζεύγη, τα ζεύγη δεσμών απωθούνται. Τότε το μόριο γίνεται γωνιακό αντί για γραμμικό.
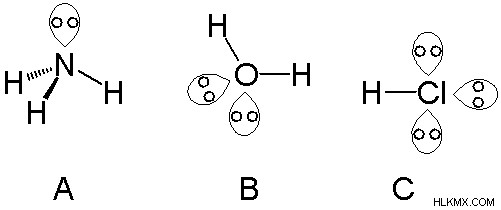
Όπως φαίνεται στην παραπάνω εικόνα, η αμμωνία έχει ένα μόνο ζεύγος, το μόριο του νερού έχει 2 μεμονωμένα ζεύγη και το HCl έχει 3 μεμονωμένα ζεύγη.
Εάν ένα άτομο έχει κενά τροχιακά, τα μόνα ζεύγη μπορούν να χωριστούν σε ασύζευκτα ηλεκτρόνια μέσω υβριδισμού τροχιακών και μπορούν να συμμετάσχουν στον δεσμό. Αλλά αν δεν υπάρχουν κενά τροχιακά, τα μόνα ζεύγη θα παραμείνουν ως ζεύγος ηλεκτρονίων και δεν θα συμμετέχουν στον δεσμό.
Για παράδειγμα, το άζωτο (N) αποτελείται από 5 ηλεκτρόνια στο εξώτατο τροχιακό. Δύο ηλεκτρόνια σε τροχιακό 2s και άλλα τρία βρίσκονται σε τρία τροχιακά p. Εφόσον το άζωτο δεν έχει κενά τροχιακά, το ζεύγος ηλεκτρονίων σε τροχιακό 2s θα παραμείνει ως μοναχικό ζεύγος.
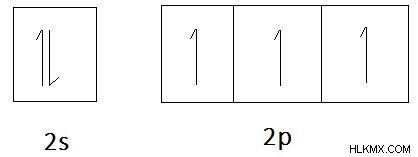
Εικόνα 3:Το τροχιακό διάγραμμα του αζώτου (N)
Αλλά όταν εξετάζουμε τον φώσφορο (P), έχει επίσης 5 ηλεκτρόνια στο εξώτατο τροχιακό:2 ηλεκτρόνια σε τροχιακό 3s και άλλα 3 ηλεκτρόνια σε τρία τροχιακά p. Όμως, ο φώσφορος μπορεί να σχηματίσει το πολύ 5 δεσμούς. Αυτό συμβαίνει επειδή έχει κενά τρισδιάστατα τροχιακά.
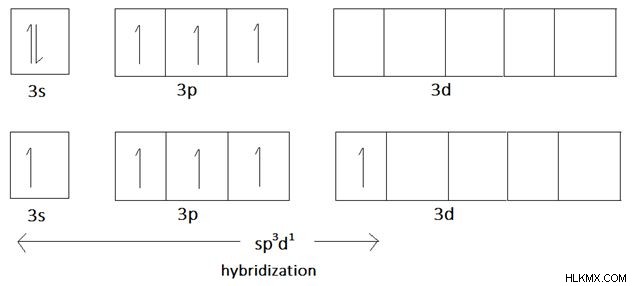
Εικόνα 4:Το τροχιακό διάγραμμα για τον φώσφορο και ο πιθανός υβριδισμός
Ο φώσφορος μπορεί να έχει πέντε δεσμούς συμπεριλαμβάνοντας τα 5 ηλεκτρόνια σε υβριδισμένα τροχιακά spd. Τότε, δεν υπάρχουν μεμονωμένα ζευγάρια στον φώσφορο.
Διαφορά μεταξύ ζεύγους ομολόγων και μοναχικού ζεύγους
Ορισμός
Ζεύγος ομολόγων: Το ζεύγος δεσμών είναι ένα ζεύγος ηλεκτρονίων που βρίσκονται σε έναν δεσμό.
Μοναχικό ζεύγος: Το μοναχικό ζεύγος είναι ένα ζεύγος ηλεκτρονίων που δεν βρίσκονται σε δεσμό.
Σύνδεση
Ζεύγος ομολόγων: Τα ζεύγη ομολόγων είναι πάντα σε ομόλογα.
Μοναχικό ζεύγος: Τα μοναχικά ζεύγη δεν είναι σε ομόλογα, αλλά μπορούν να σχηματίσουν δεσμούς δωρίζοντας το μοναχικό ζευγάρι (δεσμοί συντονισμού).
Άτομα
Ζεύγος ομολόγων: Τα δύο ηλεκτρόνια ανήκουν σε δύο άτομα σε ζεύγη δεσμών.
Μοναχικό ζεύγος: Τα δύο ηλεκτρόνια ανήκουν στο ίδιο άτομο σε μόνα ζεύγη.
Προέλευση
Ζεύγος ομολόγων: Ένα ζεύγος δεσμών δημιουργείται λόγω της κοινής χρήσης ηλεκτρονίων από δύο άτομα.
Μοναχικό ζεύγος: Ένα μοναχικό ζεύγος δημιουργείται λόγω απουσίας κενών τροχιακών.
Συμπέρασμα
Το ζεύγος δεσμών και το μοναχικό ζεύγος είναι δύο όροι που χρησιμοποιούνται για την περιγραφή συζευγμένων ηλεκτρονίων. Αυτά τα ζεύγη ηλεκτρονίων προκαλούν την αντιδραστικότητα, την πολικότητα, τη φυσική κατάσταση και τις χημικές ιδιότητες των ενώσεων. Οι ιοντικές ενώσεις μπορεί να έχουν ή να μην έχουν ζεύγη δεσμών και μεμονωμένα ζεύγη. Οι ομοιοπολικές ενώσεις και οι ενώσεις συντονισμού έχουν ουσιαστικά ζεύγη δεσμών. Μπορεί να έχουν ή να μην έχουν μοναχικά ζευγάρια. Η διαφορά μεταξύ ζεύγους δεσμών και μοναχικού ζεύγους είναι ότι ένα ζεύγος δεσμών αποτελείται από δύο ηλεκτρόνια που βρίσκονται σε έναν δεσμό ενώ ένα μοναχικό ζεύγος αποτελείται από δύο ηλεκτρόνια που δεν βρίσκονται σε δεσμό.