Πώς να υπολογίσετε την παραγγελία και το μήκος ομολόγου
Ο προσδιορισμός ορισμένων παραμέτρων όπως το μέγεθος, το μήκος και η γωνία σε ατομική κλίμακα δεν είναι εύκολος. Λόγω της σημασίας αυτών των παραμέτρων, οι επιστήμονες έχουν αναπτύξει μεθόδους για να συμπεράνουν ή να υπολογίσουν τις παραμέτρους σε ατομικό επίπεδο. Η σειρά δεσμού και το μήκος δεσμού είναι δύο τόσο σημαντικές παράμετροι που υποδεικνύουν τον τύπο και την ισχύ των δεσμών μεταξύ ενός ζεύγους ατόμων.
Αυτό το άρθρο εξηγεί,
1. Τι είναι το Bond Order και Bond Length
2. Πώς να υπολογίσετε την εντολή ομολόγου και το μήκος ομολόγου
– Πώς να υπολογίσετε την εντολή ομολόγου
– Πώς να υπολογίσετε το μήκος ομολόγου
Τι είναι η παραγγελία και το μήκος ομολόγου
Το μήκος δεσμού και η σειρά δεσμού είναι δύο παράμετροι που σχετίζονται με ομοιοπολικούς δεσμούς. Η σειρά δεσμών είναι ο αριθμός των χημικών δεσμών μεταξύ δύο ατόμων και το μήκος του δεσμού είναι η απόσταση μεταξύ δύο πυρήνων ατόμων που είναι ομοιοπολικά συνδεδεμένοι μεταξύ τους. Αυτό το άρθρο εξηγεί πώς να υπολογίσετε τη σειρά και το μήκος δεσμού σε ατομικό επίπεδο.
Πώς να υπολογίσετε την παραγγελία ομολόγων
Η σειρά δεσμών είναι ο αριθμός των χημικών δεσμών μεταξύ δύο ατόμων. Δείχνει τη σταθερότητα ενός δεσμού. Στους ομοιοπολικούς δεσμούς, η σειρά δεσμών είναι ο αριθμός των κοινών ηλεκτρονίων. Για παράδειγμα, η σειρά δεσμών ενός ζεύγους ατόμων που συνδέονται με έναν απλό δεσμό είναι μία, ενώ η σειρά δεσμού ενός ζεύγους ατόμων που συνδέονται με έναν διπλό δεσμό είναι δύο. Η μηδενική σειρά δεσμών δείχνει ότι δεν υπάρχει δεσμός μεταξύ των ατόμων. Η σταθερότητα ενός μορίου αυξάνεται με την αύξηση της σειράς δεσμών. Τα μόρια με δεσμό συντονισμού δεν χρειάζεται να είναι ακέραιος. Σε ομοιοπολικές ενώσεις με δύο άτομα, η σειρά δεσμών μεταξύ ενός ζεύγους ατόμων προσδιορίζεται αρχικά σχεδιάζοντας τη δομή Lewis και στη συνέχεια προσδιορίζοντας τον τύπο των δεσμών μεταξύ των ατόμων – μηδενικός δεσμός, απλός, διπλός ή τριπλός δεσμός. Για παράδειγμα, η σειρά δεσμών του αερίου υδρογόνου προσδιορίζεται ως εξής.
- Σχεδιάστε τη δομή Lewis
Υ:Υ
- Προσδιορίστε τον αριθμό των δεσμών/ζεύγους ηλεκτρονίων σθένους
Ένα ζεύγος ηλεκτρονίων, επομένως η σειρά δεσμών είναι 1.
Εάν υπάρχουν περισσότερα από δύο άτομα, η σειρά δεσμών καθορίζεται ως εξής. Δείτε το παράδειγμα:νιτρικό ιόν.
- Σχεδιάστε τη δομή Lewis
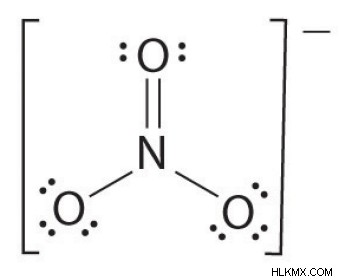
- Μετρήστε τον συνολικό αριθμό των δεσμών (σύμφωνα με το νιτρικό ιόν, είναι 4)
- Ο αριθμός των ομάδων δεσμών μεταξύ μεμονωμένων ατόμων (σύμφωνα με την αμμωνία, είναι 3)
- Ως εκ τούτου, η εντολή ομολόγων =Συνολικός αριθμός ομολόγων/ αριθμός ομάδων ομολόγων
=4/3
=1,33
Επομένως, η σειρά δεσμών του νιτρικού ιόντος είναι 1,33
Πώς να υπολογίσετε το μήκος ομολόγου
Το μήκος δεσμού είναι η απόσταση μεταξύ δύο πυρήνων ατόμων που είναι ομοιοπολικά συνδεδεμένα μεταξύ τους. Το μήκος του δεσμού είναι συνήθως στην περιοχή από 0,1 έως 0,2 nm. Όταν δύο παρόμοια άτομα συνδέονται μεταξύ τους, το ήμισυ του μήκους του δεσμού αναφέρεται ωςομοιοπολική ακτίνα . Το μήκος του δεσμού εξαρτάται από τον αριθμό των συνδεδεμένων ηλεκτρονίων δύο ατόμων ή τη σειρά του δεσμού. Όσο υψηλότερη είναι η σειρά του δεσμού, τόσο μικρότερο το μήκος του δεσμού θα οφείλεται σε ισχυρές δυνάμεις έλξης θετικά φορτισμένων πυρήνων. Η μονάδα μήκους δεσμού είναι πικόμετρο . Σε απλούς, διπλούς και τριπλούς δεσμούς, το μήκος του δεσμού αυξάνεται κατά την τάξη του
τριπλό δεσμό Η ηλεκτροαρνητικότητα μπορεί να χρησιμοποιηθεί για τον υπολογισμό του μήκους δεσμού μεταξύ δύο ατόμων που έχουν διαφορετικές ηλεκτραρνητικότητες. Ο ακόλουθος εμπειρικός τύπος προτάθηκε από τους Shoemaker και Stevenson για τον υπολογισμό του μήκους του δεσμού. dA-B =rA + rB – 0,09 (xA – xB )
dA-B είναι η απόσταση δεσμού μεταξύ δύο ατόμων Α και Β, rA και rB είναι ομοιοπολικές ακτίνες των Α και Β, και
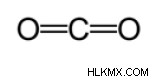
(xA – xB ) είναι η διαφορά ηλεκτραρνητικότητας μεταξύ Α και Β. Μια άλλη μέθοδος χρησιμοποιείται για τον υπολογισμό του κατά προσέγγιση μήκους δεσμού. Σε αυτή τη μέθοδο, σχεδιάζεται πρώτα η δομή Lewis για να προσδιοριστεί ο τύπος του ομοιοπολικού δεσμού. Στη συνέχεια, χρησιμοποιώντας ένα διάγραμμα* που έγινε στις μελέτες που έγιναν από τους Cordero et al ., και Pyykkö και Atsumi , προσδιορίζονται οι αντίστοιχες ακτίνες των δεσμών που δημιουργεί κάθε άτομο. Στη συνέχεια, το μήκος του δεσμού προσδιορίζεται λαμβάνοντας το άθροισμα των δύο ακτίνων. Για παράδειγμα, κατά τον προσδιορισμό του μήκους του δεσμού του διοξειδίου του άνθρακα, σχεδιάζεται πρώτα η δομή Lewis. Σύμφωνα με το διάγραμμα, η ομοιοπολική ακτίνα του διπλού δεσμού άνθρακα είναι 67 πικόμετρα και αυτή του διπλού δεσμού οξυγόνου είναι 57 πικόμετρα. Επομένως, το μήκος δεσμού του διοξειδίου του άνθρακα είναι περίπου 124 πικόμετρα (57 pm+ 67 pm).
*Το ομοιοπολικό γράφημα βρίσκεται εδώ Cordero, Beatriz, et al. «Οι ομοιοπολικές ακτίνες επανεξετάστηκαν». Dalton Transactions 21 (2008):2832-2838. Libretext. «Παραγγελία ομολόγων και μήκη». LibreTexts Χημείας. Libretexts, 05 Δεκ. 2016. Web. 10 Ιανουαρίου 2017. Ο Λίστερ, ο Τεντ και η Τζάνετ Ρένσοου. Κατανόηση της Χημείας για Προχωρημένο Επίπεδο. N.p.:Nelson Thornes, 2000. Εκτύπωση. Πρατιγιόγκιτα Νταρπάν. "Ιδιότητες των στοιχείων σε σχέση με την ηλεκτρονική τους δομή." Competition Science Vision Αύγ. 1998:n. σελ. Εκτύπωση. Pyykkö, Pekka και Michiko Atsumi. «Ομοιοπολικές ακτίνες μοριακού διπλού δεσμού για στοιχεία Li–E112». Chemistry–A European Journal 15.46 (2009):12770-12779.