Iodform Test
Η αντίδραση τριιωδομεθανίου (ιωδοφόρμιο) χρησιμοποιείται για την ανίχνευση της παρουσίας μιας ομάδας CH3CO σε αλδεΰδες και κετόνες. Αυτή η αντίδραση μπορεί να πραγματοποιηθεί με δύο μείγματα αντιδραστηρίων που φαίνεται να είναι αρκετά διαφορετικά. Χημικά, είναι εναλλάξιμα.
Χρησιμοποιώντας διάλυμα ιωδίου και υδροξειδίου του νατρίου
Χημικά, αυτή είναι η πιο προφανής τεχνική. Μια μικρή ποσότητα αλδεΰδης ή κετόνης προστίθεται σε ένα διάλυμα ιωδίου, το οποίο στη συνέχεια αφαιρείται με αρκετό διάλυμα υδροξειδίου του νατρίου για να εξαλειφθεί το χρώμα του ιωδίου. Εάν δεν συμβαίνει τίποτα στο κρύο, ο συνδυασμός μπορεί να χρειαστεί να ζεσταθεί απαλά. Η ανάπτυξη ενός πολύ ωχροκίτρινου ιζήματος τριιωδομεθανίου (παλαιότερα γνωστού ως ιωδοφόρμιο) – CHI3 – δείχνει ένα ευνοϊκό αποτέλεσμα. Εκτός από το χρώμα του, διακρίνεται από μια αόριστη «ιατρική» μυρωδιά. Είναι ένα αντιβακτηριακό που βρίσκεται σε κολλώδεις σοβάδες που χρησιμοποιούνται για τη θεραπεία μικροκοψίματος, για παράδειγμα.
Χρήση διαλύματος ιωδιούχου καλίου και χλωρικού νατρίου(I)
Το υποχλωριώδες νάτριο είναι ένα άλλο όνομα για το χλωρικό νάτριο(I). Λίγη ποσότητα αλδεΰδης ή κετόνης αναμιγνύεται με διάλυμα ιωδιούχου καλίου και μετά διάλυμα χλωρικού νατρίου (Ι). Εάν δεν σχηματιστεί ίζημα όταν το μείγμα είναι κρύο, μπορεί να χρειαστεί να θερμανθεί προσεκτικά το μείγμα. Το ευνοϊκό αποτέλεσμα είναι το ίδιο ωχροκίτρινο ίζημα που είχε παρατηρηθεί προηγουμένως.
Η αντίδραση τριιωδομεθανίου (ιωδοφορμίου)
Μια αλδεΰδη ή κετόνη που φέρει την ομαδοποίηση:δίνει ένα θετικό αποτέλεσμα - το ωχροκίτρινο ίζημα του τριιωδομεθανίου (ιωδοφόρμιο).

Ένα άτομο υδρογόνου ή μια ομάδα υδρογονάνθρακα μπορεί να χρησιμοποιηθεί ως "R". (για παράδειγμα, μια αλκυλομάδα). Εάν το "R" είναι υδρογόνο, σχηματίζεται η αιθανάλη αλδεΰδης, CH3CHO.
Η αντίδραση τριιωδομεθανίου (ιωδοφόρμιο) μπορεί να παραχθεί μόνο με αιθανάλη.
Έχετε μια κετόνη εάν το "R" είναι μια ομάδα υδρογονανθράκων. Αυτή η αντίδραση πυροδοτείται από μια ομάδα μεθυλίου στη μία πλευρά του διπλού δεσμού άνθρακα-οξυγόνου, που υπάρχει σε πολλές κετόνες. Είναι γνωστές ως μεθυλκετόνες.
Εξίσωση για την αντίδραση ιωδοφόρμου
Οι εξισώσεις αντίδρασης τριιωδομεθανίου (ιωδοφόρμιο)
Θα χρησιμοποιήσουμε διάλυμα ιωδίου και υδροξειδίου του νατρίου ως αντιδραστήριά μας. Το πρώτο στάδιο περιλαμβάνει άτομα ιωδίου που αντικαθιστούν και τα τρία υδρογόνα στην ομάδα μεθυλίου. Η παρουσία ιόντων υδροξειδίου είναι απαραίτητη για να πραγματοποιηθεί η αντίδραση επειδή εμπλέκονται στη διαδικασία.
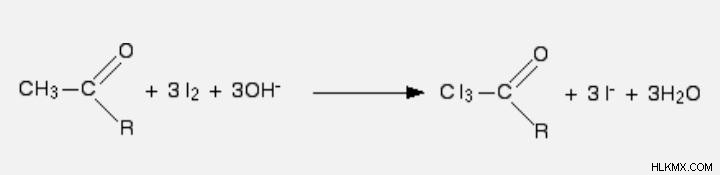
Η σύνδεση μεταξύ του CI3 και του υπόλοιπου μορίου διακόπτεται στο δεύτερο στάδιο, παράγοντας τριιωδομεθάνιο (ιωδοφόρμιο) και ένα άλας οξέος.
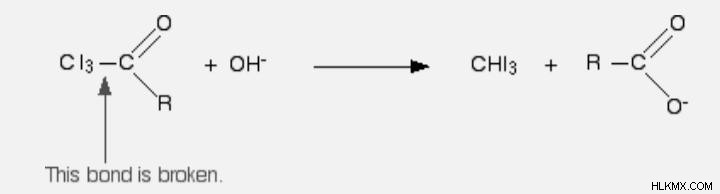
Όταν τα αθροίσετε όλα, λαμβάνετε την ακόλουθη εξίσωση απόκρισης:
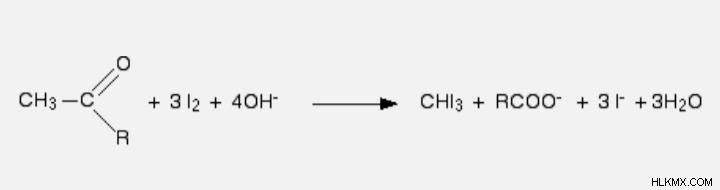
Τι δείχνει η αντίδραση ιωδοφόρμιου;
Η ανάπτυξη ενός ωχροκίτρινου ιζήματος τριιωδομεθανίου (ιωδοφόρμιο) – ένα θετικό αποτέλεσμα – παρέχεται από μια αλκοόλη που περιέχει την ομαδοποίηση:
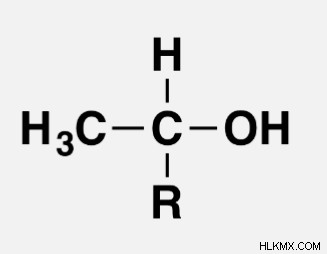
Ένα άτομο υδρογόνου ή μια ομάδα υδρογονάνθρακα μπορεί να χρησιμοποιηθεί ως "R". (για παράδειγμα, μια αλκυλομάδα). Εάν το "R" είναι υδρογόνο, λαμβάνετε CH3CH2OH, που είναι η πρωτογενής αλκοόλη.
Η αντίδραση τριιωδομεθανίου (ιωδοφόρμιο) λαμβάνει χώρα μόνο με την αιθανόλη ως κύρια αλκοόλη.
Μπορεί να έχουμε δευτερεύουσα αλκοόλη εάν το "R" είναι μια ομάδα υδρογονανθράκων. Αυτή η αντίδραση εμφανίζεται σε μια ποικιλία δευτεροταγών αλκοολών, αλλά αυτές που έχουν όλες έχουν μια μεθυλική ομάδα συνδεδεμένη στον άνθρακα με την ομάδα -ΟΗ.
Επειδή καμία τριτοταγής αλκοόλη δεν μπορεί να έχει άτομο υδρογόνου συνδεδεμένο με τον άνθρακα με την ομάδα -OH, καμία τριτοταγής αλκοόλη δεν μπορεί να περιέχει αυτήν την ομάδα. Η αντίδραση τριιωδομεθανίου (ιωδοφόρμιο) δεν συμβαίνει με καμία τριτοταγή αλκοόλη.
Φυσικές ιδιότητες του ιωδοφόρμιου
Το ιωδοφόρμιο έχει τα ακόλουθα σημαντικά φυσικά χαρακτηριστικά:
1. Έχει σημείο τήξης 121 βαθμούς Κελσίου και είναι ένα κίτρινο κρυσταλλικό στερεό.
2. Έχει μια ευδιάκριτη και δυσάρεστη μυρωδιά.
3. Είναι αδιάλυτο στο νερό, αν και διαλυτό σε αιθυλική αλκοόλη και αιθέρα .
Χημικές ιδιότητες του ιωδοφόρμιου
Η χημική συμπεριφορά του ιωδοφόρμιου είναι σχεδόν ίδια με αυτή του χλωροφορμίου. Το χλωροφόρμιο, από την άλλη πλευρά, είναι λιγότερο σταθερό. Ακολουθούν μερικές από τις πιο σημαντικές χημικές ιδιότητες του ιωδοφόρμιου:
Ανάδραση καρβυλαμίνης Αντίδραση :Όταν το ιωδοφόρμιο καίγεται με πρωτοταγή (1) αμίνη (αρωματική ή αλειφατική) και αλκοολική καυστική ποτάσα, παράγεται ένα συγκρίσιμο ισοκυανίδιο ή καρβυλαμίνη.
Μείωση:Όταν ανάγεται με κόκκινο φώσφορο και υδροϊωδικό οξύ, παράγει ιωδιούχο μεθυλένιο.
Υδρόλυση :Όταν θερμαίνεται με αλκοολικό υδροξείδιο του καλίου, υφίσταται αντίδραση υδρόλυσης, απελευθερώνοντας μυρμηκικό οξύ, το οποίο αλληλεπιδρά με το ΚΟΗ για την παραγωγή μυρμηκικού καλίου.
Αποαλογόνωση :Όταν θερμαίνεται με σκόνη αργύρου, υφίσταται αντίδραση αφαλογόνωσης και αποδίδει ακετυλένιο.
Αντίδραση με νιτρικό άργυρο :Το ιωδοφόρμιο παράγει ένα κίτρινο ίζημα ιωδιούχου αργύρου όταν θερμαίνεται με αλκοολικό νιτρικό άργυρο. Σε αυτήν την αντίδραση, συμπεριφέρεται διαφορετικά από το χλωροφόρμιο, το οποίο δεν καθιζάνει με νιτρικό άργυρο.
Σταθερότητα :Όταν θερμαίνεται, το ιωδοφόρμιο αποσυντίθεται σε ατμούς ιωδίου. Όταν έρχεται σε επαφή με τον αέρα, την υγρασία ή το φως, αποσυντίθεται. Λόγω της απελευθέρωσης ελεύθερου ιωδίου, έχει αντιμικροβιακή δράση.
Συμπέρασμα
Το ιωδοφόρμιο είναι μια εξαιρετικά εύφλεκτη κρυσταλλική ωχροκίτρινη ουσία. Είναι αδιάλυτο στο νερό, αν και η αιθυλική αλκοόλη και ο αιθέρας είναι. Η χημική συμπεριφορά του ιωδοφόρμιου είναι σχεδόν ίδια με αυτή του χλωροφορμίου. Η παρουσία μιας αλδεΰδης ή κετόνης στην οποία μια ομάδα μεθυλίου είναι μία από τις ομάδες που συνδέονται άμεσα με τον άνθρακα καρβονυλίου ανιχνεύεται με τη δοκιμή ιωδοφορμίου. Χρησιμοποιείται επίσης ως αντισηπτικό και στη φαρμακοβιομηχανία, μεταξύ άλλων. Οι δοκιμές ιωδοφορμίου μπορούν επίσης να χρησιμοποιηθούν για τη διάκριση μεταξύ πολλών ζευγών χημικών ουσιών.




