Διαφορά μεταξύ ηλεκτροσθενούς και ομοιοπολικού δεσμού
Κύρια διαφορά – Ηλεκτροσθενής έναντι ομοιοπολικού δεσμού
Ο ηλεκτροσθενής και ο ομοιοπολικός δεσμός είναι δύο τύποι χημικών δεσμών που βρίσκονται μεταξύ ατόμων ενός μορίου ή μιας ένωσης. Αυτοί οι δεσμοί βοηθούν στη συγκράτηση των ατόμων μαζί. Ο σχηματισμός αυτών των δύο τύπων δεσμών συμβαίνει λόγω της ανταλλαγής ηλεκτρονίων μεταξύ δύο ατόμων. Ο ηλεκτροσθενής δεσμός ονομάζεται επίσης ιονικός δεσμός . Είναι μια ηλεκτροστατική έλξη μεταξύ δύο ατόμων. Ένας ομοιοπολικός δεσμός είναι αποτέλεσμα της κοινής χρήσης ηλεκτρονίων μεταξύ δύο ατόμων. Η κύρια διαφορά μεταξύ ηλεκτροσθενούς και ομοιοπολικού δεσμού είναι ότι ο ηλεκτροσθενής δεσμός σχηματίζεται όταν δύο άτομα βρίσκονται σε ηλεκτροστατική έλξη, ενώ ο ομοιοπολικός δεσμός σχηματίζεται όταν δύο άτομα μοιράζονται τα ηλεκτρόνια τους μεταξύ τους.
Βασικές περιοχές που καλύπτονται
1. Τι είναι ο Ηλεκτροσθενής Δεσμός
– Ορισμός, εξήγηση του σχηματισμού με παραδείγματα
2. Τι είναι ο ομοιοπολικός δεσμός
– Ορισμός, εξήγηση του σχηματισμού με παραδείγματα
3. Ποιες είναι οι ομοιότητες μεταξύ ηλεκτροσθενούς και ομοιοπολικού δεσμού
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά μεταξύ ηλεκτροσθενούς και ομοιοπολικού δεσμού
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ομοιοπολικός δεσμός, Ηλεκτραρνητικότητα, Ηλεκτροστατική έλξη, Ηλεκτροσθενής δεσμός, Ιωνικός δεσμός, Ευγενές αέριο
Τι είναι ένας Ηλεκτροσθενής Δεσμός
Ο ηλεκτροσθενής δεσμός είναι ένας τύπος χημικού δεσμού που μπορεί να οριστεί ως ηλεκτροστατική έλξη μεταξύ δύο ατόμων. Εδώ, τα δύο άτομα είτε χάνουν εντελώς είτε αποκτούν εντελώς ηλεκτρόνια. Επομένως, τα δύο άτομα γίνονται ιόντα. Το άτομο που χάνει ηλεκτρόνια γίνεται κατιόν ενώ το άτομο που αποκτά ηλεκτρόνια γίνεται ανιόν. Επομένως, τα δύο άτομα δημιουργούν μια δύναμη έλξης μετά την ανταλλαγή ηλεκτρονίων, καθώς είναι αντίθετα φορτισμένα ιόντα. Αυτή η δύναμη έλξης είναι μια ηλεκτροστατική έλξη. Είναι χρήσιμο να κρατάτε τα δύο άτομα μαζί σχηματίζοντας ένα ιοντικό μόριο.
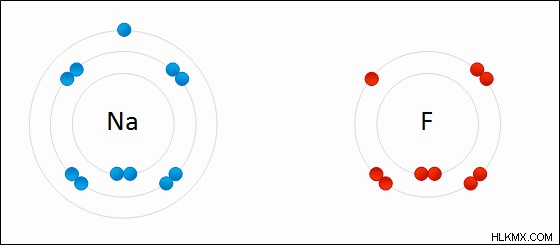
Εικόνα 01:Σχηματισμός ιοντικού δεσμού μεταξύ μετάλλου νατρίου (Na) και χλωρίου (Cl)
Στις περισσότερες περιπτώσεις, το κατιόν είναι μέταλλο. Αυτό συμβαίνει επειδή τα μέταλλα τείνουν να χάνουν τα ηλεκτρόνια που βρίσκονται στο εξώτατο τροχιακό αντί να αποκτούν μεγάλο αριθμό ηλεκτρονίων για να γεμίσουν αυτό το τροχιακό. Τότε, το ανιόν θα είναι ένα αμέταλλο. Αυτό συμβαίνει επειδή τα αμέταλλα τείνουν να αποκτούν ηλεκτρόνια αντί να χάνουν όλα τα ηλεκτρόνια στο εξώτατο τροχιακό τους.
Αυτός ο τύπος δεσμού ονομάζεται ηλεκτροσθενής δεσμός επειδή τα άτομα εδώ δεν χάνουν ή κερδίζουν εντελώς ηλεκτρόνια αφού βρίσκονται σε μια έλξη. έχουν κάποιο βαθμό χαρακτήρα ομοιοπολικού δεσμού. Επομένως, δεν πρόκειται για έναν εντελώς ιοντικό δεσμό.
Η ισχύς του ιοντικού δεσμού εξαρτάται από διάφορους παράγοντες.
- Μέγεθος του κατιόντος – εάν το κατιόν είναι πολύ μικρό σε σύγκριση με το ανιόν, ο ιοντικός δεσμός είναι πολύ ισχυρός.
- μέγεθος του ανιόντος – εάν το ανιόν είναι πολύ μεγάλο σε σύγκριση με το κατιόν, ο ιοντικός δεσμός είναι πολύ ισχυρός
- Φόρτιση του ιόντος – εάν το φορτίο των ιόντων είναι υψηλό, ο ιοντικός δεσμός θα είναι ισχυρότερος.
Όταν συγκρίνετε δύο διαφορετικούς ιοντικούς δεσμούς, πρέπει πρώτα να λάβετε υπόψη το φορτίο και μετά το μέγεθος των ιόντων. Αυτοί οι ιοντικοί δεσμοί σχηματίζονται μεταξύ των ατόμων επειδή πρέπει να σταθεροποιηθούν αποκτώντας την πλησιέστερη διαμόρφωση ηλεκτρονίων ευγενούς αερίου είτε αφαιρώντας είτε λαμβάνοντας ηλεκτρόνια.
Αυτή η σχεδόν πλήρης μεταφορά ηλεκτρονίων προκαλείται από την υψηλή διαφορά στις ηλεκτραρνητικότητα αυτών των ατόμων. Τα άτομα με υψηλότερη ηλεκτραρνητικότητα θα προσελκύουν ηλεκτρόνια περισσότερο από τα άτομα με χαμηλότερη ηλεκτραρνητικότητα.
Τι είναι ο ομοιοπολικός δεσμός
Ο ομοιοπολικός δεσμός είναι ένας τύπος χημικού δεσμού που σχηματίζεται λόγω της κοινής χρήσης ηλεκτρονίων μεταξύ δύο ατόμων. Αυτός ο τύπος δεσμού σχηματίζεται μεταξύ ατόμων που έχουν μικρότερη (από 1,7) ή καμία διαφορά μεταξύ των τιμών ηλεκτραρνητικότητας τους. Επομένως, τα περισσότερα αμέταλλα σχηματίζουν ομοιοπολικούς δεσμούς μεταξύ τους. Επιπλέον, τα άτομα του ίδιου στοιχείου σχηματίζουν μόνο ομοιοπολικούς δεσμούς.
Ένας ομοιοπολικός δεσμός έχει δύο ηλεκτρόνια που είναι γνωστά ως ζεύγος ηλεκτρονίων δεσμού. Αυτό το ζεύγος ηλεκτρονίων δεσμού σχηματίζεται από το ζεύγος ηλεκτρονίων που δίνει κάθε άτομο. Κάθε άτομο δίνει ένα ηλεκτρόνιο ανά ομοιοπολικό δεσμό. Επομένως, ορισμένα άτομα μπορούν να δώσουν περισσότερα από ένα ηλεκτρόνια ανάλογα με τον αριθμό των ηλεκτρονίων σθένους τους. Τότε αυτά τα άτομα θα έχουν περισσότερους από έναν ομοιοπολικούς δεσμούς.
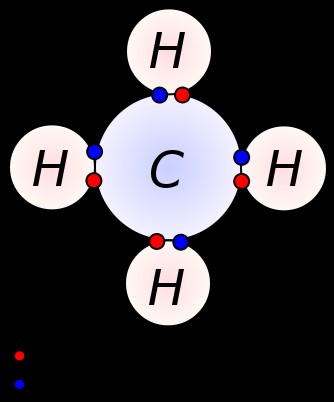
Εικόνα 2:Το μόριο CH4 έχει τέσσερις ομοιοπολικούς δεσμούς. Επομένως, υπάρχουν τέσσερα ζεύγη ηλεκτρονίων δεσμών γύρω από το άτομο άνθρακα.
Για να σχηματιστεί ένας ομοιοπολικός δεσμός, ένα άτομο θα πρέπει να έχει τουλάχιστον ένα ασύζευκτο ηλεκτρόνιο στο εξώτατο τροχιακό. Στη συνέχεια, αυτό το ηλεκτρόνιο μπορεί να ζευγαρωθεί με ένα άλλο ηλεκτρόνιο που μοιράζεται ένα διαφορετικό άτομο. Σύμφωνα με το τροχιακό όπου υπάρχει το ασύζευκτο ηλεκτρόνιο, ο σχηματιζόμενος δεσμός μπορεί να είναι είτε σίγμα είτε δεσμός π. Ωστόσο, σύμφωνα με την ηλεκτραρνητικότητα δύο ατόμων, ο ομοιοπολικός δεσμός μπορεί να υπάρχει είτε ως πολικός ομοιοπολικός δεσμός είτε ως μη πολικός ομοιοπολικός δεσμός. Ένας πολικός ομοιοπολικός δεσμός σχηματίζεται όταν η διαφορά μεταξύ δύο τιμών ηλεκτραρνητικότητας είναι μεταξύ 0,4 και 1,7. Αλλά αν οι τιμές ηλεκτραρνητικότητας διαφέρουν μόνο κατά 0,4 μονάδες, τότε πρόκειται για μη πολικό ομοιοπολικό δεσμό.
Ομοιότητες μεταξύ ηλεκτροσθενούς και ομοιοπολικού δεσμού
- Ο ηλεκτροσθενής και ο ομοιοπολικός δεσμός είναι τύποι χημικών δεσμών.
- Και οι δύο τύποι σχηματίζονται λόγω της ανταλλαγής ηλεκτρονίων μεταξύ δύο ή περισσότερων ατόμων.
- Και οι δύο τύποι δεσμών προκαλούν τη συγκράτηση δύο ατόμων.
Διαφορά μεταξύ Ηλεκτροσθενούς και Ομοπολικού δεσμού
Ορισμός
Ηλεκτροδύναμος δεσμός: Ο ηλεκτροσθενής δεσμός είναι ένας τύπος χημικού δεσμού που μπορεί να οριστεί ως ηλεκτροστατική έλξη μεταξύ δύο ατόμων.
Ομοιοπολικός δεσμός: Ο ομοιοπολικός δεσμός είναι ένας τύπος χημικού δεσμού που σχηματίζεται λόγω της κοινής χρήσης ηλεκτρονίων μεταξύ δύο ατόμων.
Η φύση του δεσμού
Ηλεκτροσθενής δεσμός: Ο ηλεκτροσθενής δεσμός είναι ένας τύπος ηλεκτροστατικής έλξης μεταξύ δύο ατόμων.
Ομοιοπολικός δεσμός: Ο ομοιοπολικός δεσμός είναι ένας άμεσος χημικός δεσμός μεταξύ δύο ατόμων.
Ηλεκτραρνητικότητα
Ηλεκτροδύναμος δεσμός: Η διαφορά στις τιμές ηλεκτραρνητικότητας των ατόμων θα πρέπει να είναι μεγαλύτερη από 1,7 για να σχηματιστεί ένας ηλεκτροσθενής δεσμός.
Ομοιοπολικός δεσμός: Η διαφορά στις τιμές ηλεκτραρνητικότητας των ατόμων πρέπει να είναι μικρότερη από 1,7 προκειμένου να σχηματιστεί ένας ομοιοπολικός δεσμός.
Ιόντα εναντίον ατόμων
Ηλεκτροσθενής δεσμός: Τα ιόντα συμμετέχουν στο σχηματισμό ηλεκτροσθενών δεσμών.
Ομοιοπολικός δεσμός: Τα άτομα εμπλέκονται στο σχηματισμό ομοιοπολικών δεσμών.
Συμπέρασμα
Οι ηλεκτροσθενείς και ομοιοπολικοί δεσμοί είναι τύποι χημικών δεσμών. Αυτοί οι δεσμοί σχηματίζονται λόγω της ανταλλαγής ηλεκτρονίων μεταξύ των ατόμων. Ένα άτομο μπορεί να έχει περισσότερους από έναν ηλεκτροσθενείς ή ομοιοπολικούς δεσμούς. Η κύρια διαφορά μεταξύ ηλεκτροσθενούς και ομοιοπολικού δεσμού είναι ότι ο ηλεκτροσθενής δεσμός σχηματίζεται όταν δύο άτομα βρίσκονται σε ηλεκτροστατική έλξη, ενώ ο ομοιοπολικός δεσμός σχηματίζεται όταν δύο άτομα μοιράζονται τα ηλεκτρόνια τους μεταξύ τους.
Εικόνα Ευγενική προσφορά:
1. «NaF» By Wdcf – Δική μου εργασία (CC BY-SA 3.0) μέσω Commons Wikimedia
2. «Covalent» By DynaBlast – Δημιουργήθηκε με Inkscape (CC BY-SA 2.5) μέσω Commons Wikimedia




