Διαφορά μεταξύ δεσμευτικών και αντιδεσμικών μοριακών τροχιακών
Κύρια διαφορά – Συγκόλληση έναντι Μοριακών Τροχιακών Αντιδεσμών
Η μοριακή τροχιακή θεωρία εξηγεί τον χημικό δεσμό μεταξύ ατόμων σε ένα μόριο. Δηλώνει ότι δύο ατομικά τροχιακά επικαλύπτονται μεταξύ τους για να σχηματίσουν έναν δεσμό. Αυτή η επικάλυψη προκαλεί την ανάμειξη δύο τροχιακών, σχηματίζοντας ένα μοριακό τροχιακό. Υπάρχουν δύο τύποι μοριακών τροχιακών:τα συνδετικά μοριακά τροχιακά και τα αντιδεσμικά μοριακά τροχιακά. Τα συνδετικά μοριακά τροχιακά αποτελούνται από ηλεκτρόνια δεσμού. Αυτά τα ηλεκτρόνια ζευγαρώνονται μεταξύ τους σχηματίζοντας έναν ομοιοπολικό δεσμό. Τα αντιδεσμικά μοριακά τροχιακά βρίσκονται έξω από τον δεσμό αφού δεν συμμετέχουν στον δεσμό. Η κύρια διαφορά μεταξύ δεσμευτικών και αντισυνδεδεμένων μοριακών τροχιακών είναι ότι τα δεσμευτικά μοριακά τροχιακά αντιπροσωπεύουν το σχήμα ενός μορίου, ενώ τα αντισυνδεδεμένα μοριακά τροχιακά δεν συμβάλλουν στον προσδιορισμό του σχήματος ενός μορίου.
Βασικές περιοχές που καλύπτονται
1. Τι είναι τα Μοριακά Τροχιακά Συγκόλλησης
– Ορισμός, δομές, συνεισφορά στη χημική σύνδεση
2. Τι είναι τα αντιδεσμικά μοριακά τροχιακά
– Ορισμός, δομές, συνεισφορά στη χημική σύνδεση
3. Ποια είναι η διαφορά μεταξύ δεσμευτικών και αντιδεσμικών μοριακών τροχιακών
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Αντισυνδεδεμένο μοριακό τροχιακό, αστερίσκος, ατομικό τροχιακό, ζεύγος ηλεκτρονίων δεσμού, μοριακό τροχιακό δεσμού, θεωρία μοριακών τροχιακών 
Τι είναι τα Bonding Molecular Orbitals
Τα συνδετικά μοριακά τροχιακά είναι ένας τύπος μοριακών τροχιακών που εμπλέκονται στο σχηματισμό ενός χημικού δεσμού. Αυτά τα τροχιακά σχηματίζονται λόγω της επικάλυψης δύο ατομικών τροχιακών δύο διαφορετικών ατόμων. Αυτή η επικάλυψη έχει ως αποτέλεσμα την ανάμειξη δύο ατομικών τροχιακών, σχηματίζοντας τα μοριακά τροχιακά. Για να αναμιχθούν έτσι, τα δύο ατομικά τροχιακά θα πρέπει να έχουν συγκρίσιμες ενέργειες και σωστή συμμετρία.
Η πυκνότητα ηλεκτρονίων των συνδεόμενων μοριακών τροχιακών είναι υψηλότερη από αυτή των αντιδεσμικών τροχιακών. Η ενέργεια αυτών των δεσμευτικών μοριακών τροχιακών είναι μικρότερη από εκείνη των ατομικών τροχιακών που αναμίχθηκαν μεταξύ τους για να σχηματίσουν το δεσμευτικό μοριακό τροχιακό. Αυτά τα συνδετικά μοριακά τροχιακά είναι πιο σταθερά καθώς ένα χαμηλότερο επίπεδο ενέργειας υποδηλώνει υψηλότερη σταθερότητα.
Επιπλέον, τα συνδετικά μοριακά τροχιακά συμβάλλουν στον προσδιορισμό της μοριακής γεωμετρίας ενός συγκεκριμένου μορίου. Η χωρική διάταξη αυτών των δεσμευτικών μοριακών τροχιακών αντιπροσωπεύει το σχήμα του μορίου αφού τα ζεύγη ηλεκτρονίων του δεσμού βρίσκονται σε αυτά τα συνδετικά μοριακά τροχιακά.
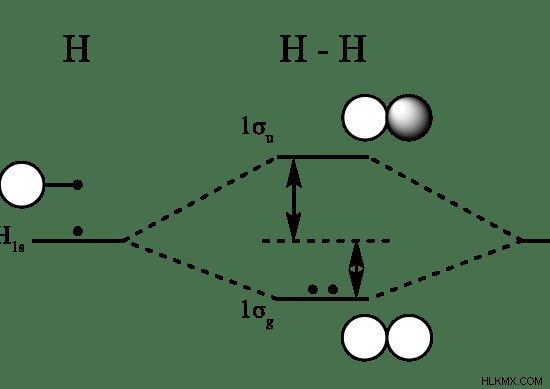
Εικόνα 1:Μοριακό τροχιακό διάγραμμα του H2
Η παραπάνω εικόνα δείχνει το μοριακό τροχιακό διάγραμμα του He2 μόριο. Τα ατομικά τροχιακά δύο ατόμων Η φαίνονται στη δεξιά και την αριστερή πλευρά. Στη μέση, φαίνονται τα τροχιακά σύνδεσης και αντισυγκόλλησης. Εδώ, το τροχιακό δεσμού δίνεται ως σ1s γιατί είναι το τροχιακό δεσμού του τροχιακού 1s του Η. Το «Ε» αντιπροσωπεύει την ενέργεια. Επομένως, το ενεργειακό επίπεδο των δεσμευτικών μοριακών τροχιακών είναι μικρότερο από αυτό των αντιδεσμικών μοριακών τροχιακών και των ατομικών τροχιακών.
Τι είναι τα Antibonding Molecular Orbitals
Αντιδεσμικά μοριακά τροχιακά είναι τροχιακά που περιέχουν ηλεκτρόνια εκτός της περιοχής μεταξύ δύο ατομικών πυρήνων. Τα ηλεκτρόνια στα αντιδεσμικά τροχιακά μειώνουν τη σταθερότητα ενός μορίου αφού αυτά τα ηλεκτρόνια περνούν τον περισσότερο χρόνο τους έξω από τους ατομικούς πυρήνες. Επομένως, η πυκνότητα ηλεκτρονίων των αντιδεσμικών μοριακών τροχιακών είναι μικρότερη σε σύγκριση με αυτή των δεσμευτικών μοριακών τροχιακών και τα αντιδεσμικά μοριακά τροχιακά υποδεικνύουν την πυκνότητα ηλεκτρονίων έξω από τον δεσμό.
Τα αντιδεσμικά μοριακά τροχιακά έχουν υψηλότερη ενέργεια από αυτή των ατομικών τροχιακών και των δεσμευτικών μοριακών τροχιακών. Αυτό συμβαίνει επειδή τα ηλεκτρόνια σε αυτά τα τροχιακά δεν συμβάλλουν στη μείωση της απώθησης μεταξύ δύο ατομικών πυρήνων. Επομένως, η σταθερότητα των ενώσεων που έχουν ηλεκτρόνια στα αντιδεσμικά μοριακά τροχιακά είναι χαμηλότερη. Ωστόσο, σε σταθερές ενώσεις, η παρουσία ηλεκτρονίων στα αντιδεσμικά μοριακά τροχιακά δεν είναι καθόλου ή λιγότερη. Η χωρική διάταξη των αντιδεσμικών μοριακών τροχιακών δεν καθορίζει το σχήμα ή τη γεωμετρία ενός μορίου.
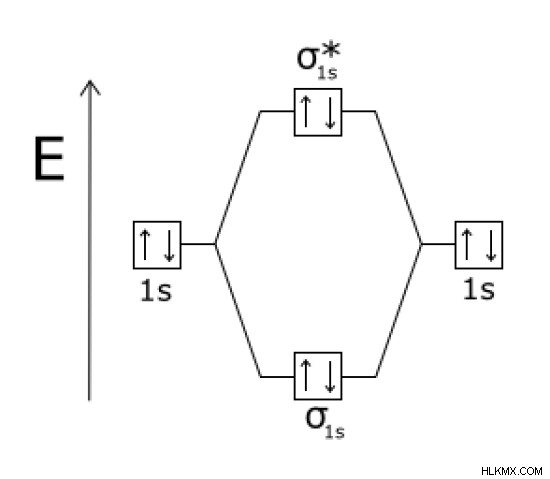
Εικόνα 2:Μοριακή τροχιακή ενέργεια του He2 Μόριο
Σύμφωνα με την παραπάνω εικόνα, η πυκνότητα ηλεκτρονίων στο δεσμευτικό μοριακό τροχιακό είναι ίση με αυτή του αντιδεσμικού μοριακού τροχιακού. Επομένως, είναι ένα πολύ ασταθές μόριο. Ως εκ τούτου, He2 μόριο δεν υπάρχει. Το αντιδεσμικό μοριακό τροχιακό δίνεται ως σ*.
Διαφορά μεταξύ Bonding και Antibonding Molecular Orbitals
Ορισμός
Μοριακά τροχιακά σύνδεσης: Τα συνδετικά μοριακά τροχιακά είναι ένας τύπος μοριακών τροχιακών που εμπλέκονται στο σχηματισμό ενός χημικού δεσμού.
Αντιδεσμικά Μοριακά Τροχιακά: Τα αντιδεσμικά μοριακά τροχιακά είναι τροχιακά που περιέχουν ηλεκτρόνια εκτός της περιοχής μεταξύ δύο ατομικών πυρήνων.
Πυκνότητα ηλεκτρονίων
Μοριακά τροχιακά σύνδεσης: Η πυκνότητα ηλεκτρονίων στα συνδεόμενα μοριακά τροχιακά είναι υψηλότερη.
Αντιδεσμικά Μοριακά Τροχιακά: Η πυκνότητα ηλεκτρονίων στα αντιδεσμικά μοριακά τροχιακά είναι χαμηλή.
Ενέργεια
Μοριακά τροχιακά σύνδεσης: Η ενέργεια του δεσμού μοριακού τροχιακού είναι συγκριτικά χαμηλότερη.
Αντιδεσμικά Μοριακά Τροχιακά: Η ενέργεια του αντιδεσμικού μοριακού τροχιακού είναι συγκριτικά υψηλότερη.
Αναπαράσταση
Μοριακά τροχιακά σύνδεσης: Τα συνδετικά μοριακά τροχιακά αναπαρίστανται χωρίς τη χρήση αστερίσκου (*).
Αντιδεσμικά Μοριακά Τροχιακά: Τα αντιδεσμικά μοριακά τροχιακά αντιπροσωπεύονται με αστερίσκο (*).
Γεωμετρία του μορίου
Μοριακά τροχιακά σύνδεσης: Η γεωμετρία ενός μορίου αντιπροσωπεύεται από τη χωρική διάταξη των συνδεόμενων μοριακών τροχιακών.
Αντιδεσμικά Μοριακά Τροχιακά: Η γεωμετρία ενός μορίου δεν εξαρτάται από τη χωρική διάταξη των αντιδεσμικών μοριακών τροχιακών.
Ηλεκτρόνια
Μοριακά τροχιακά σύνδεσης: Τα ηλεκτρόνια στο δεσμευτικό μοριακό τροχιακό συμβάλλουν στο σχηματισμό ενός δεσμού.
Αντιδεσμικά Μοριακά Τροχιακά: Τα ηλεκτρόνια στα αντιδεσμικά μοριακά τροχιακά δεν συμβάλλουν στο σχηματισμό του δεσμού.
Σταθερότητα
Συγκόλληση Μοριακών Τροχιακών: Η σταθερότητα των δεσμευτικών μοριακών τροχιακών είναι συγκριτικά υψηλότερη.
Αντιδεσμικά Μοριακά Τροχιακά: Η σταθερότητα των αντιδεσμικών μοριακών τροχιακών είναι συγκριτικά χαμηλότερη.
Συμπέρασμα
Η μοριακή τροχιακή θεωρία εξηγεί το σχηματισμό ενός χημικού δεσμού μεταξύ δύο ατόμων μέσω επικάλυψης ή ανάμειξης ατομικών τροχιακών. Αυτή η ανάμειξη ατομικών τροχιακών σχηματίζει νέα τροχιακά που ονομάζονται μοριακά τροχιακά. Τα μοριακά τροχιακά μπορούν να βρεθούν είτε ως δεσμευτικά μοριακά τροχιακά είτε ως μοριακά τροχιακά ως αντισυνδεδεμένα. Η κύρια διαφορά μεταξύ δεσμευτικών και αντισυνδεδεμένων μοριακών τροχιακών είναι ότι τα συνδετικά μοριακά τροχιακά αντιπροσωπεύουν το σχήμα ενός μορίου, ενώ τα αντιδεσμικά μοριακά τροχιακά δεν συμβάλλουν στον προσδιορισμό του σχήματος ενός μορίου.




