Διαφορά μεταξύ μετάλλων μετάβασης και μετάλλων εσωτερικής μετάβασης
Κύρια διαφορά – Μεταβατικά μέταλλα έναντι μετάλλων εσωτερικής μετάβασης
Ο περιοδικός πίνακας των στοιχείων αποτελείται από μέταλλα, αμέταλλα και μεταλλοειδή. Τα χημικά στοιχεία κατηγοριοποιούνται ως μέταλλα εάν έχουν μεταλλικές ιδιότητες όπως ελατότητα, καλή ηλεκτρική αγωγιμότητα, αφαιρούνται εύκολα ηλεκτρόνια, κ.λπ. Τα περισσότερα στοιχεία μπλοκ d θεωρούνται ως μέταλλα μετάπτωσης. Τα στοιχεία μπλοκ F θεωρούνται ως μέταλλα εσωτερικής μετάπτωσης. Η κύρια διαφορά μεταξύ των μετάλλων μεταπτώσεως και των εσωτερικών μετάλλων μετάπτωσης είναι ότι τα άτομα μετάλλων μεταπτώσεως έχουν τα ηλεκτρόνια σθένους στο εξώτατο d τροχιακό, ενώ τα άτομα του εσωτερικού μετάλλου μετάπτωσης έχουν τα ηλεκτρόνια σθένους στο τροχιακό f του εσωτερικού προτελευταίου κελύφους ηλεκτρονίων.
Βασικές περιοχές που καλύπτονται
1. Τι είναι τα Μεταβατικά Μέταλλα
– Ορισμός, Ιδιότητες σε σχέση με την ηλεκτρονική διαμόρφωση
2. Τι είναι τα μέταλλα εσωτερικής μετάβασης
– Ορισμός, Ιδιότητες σε σχέση με την ηλεκτρονική διαμόρφωση
3. Ποια είναι η διαφορά μεταξύ των μετάλλων μετάβασης και των μετάλλων εσωτερικής μετάβασης
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ακτινίδες, D Orbital, F Orbital, Inner Transition Metal, Lanthanides, Transition Metal
Τι είναι τα Μεταβατικά Μέταλλα
Τα μεταβατικά μέταλλα είναι χημικά στοιχεία που αποτελούνται από άτομα με ασύζευκτα ηλεκτρόνια d. Ακόμη και τα σταθερά κατιόντα που δημιουργούν αυτά τα στοιχεία έχουν ασύζευκτα ηλεκτρόνια d. Τα περισσότερα στοιχεία μπλοκ d είναι μέταλλα μετάπτωσης. Ωστόσο, το σκάνδιο (Sc) και ο ψευδάργυρος (Zn) δεν θεωρούνται ως μέταλλα μετάπτωσης αφού δεν έχουν ασύζευκτα ηλεκτρόνια d, ακόμη και στα σταθερά κατιόντα που σχηματίζουν. Το σκάνδιο σχηματίζει το Sc ως το μόνο σταθερό κατιόν και δεν έχει d ηλεκτρόνια. Ο Zn σχηματίζει το κατιόν Zn ως το μόνο σταθερό κατιόν. Έχει d ηλεκτρόνια, αλλά όλα είναι ζευγαρωμένα.
Στον περιοδικό πίνακα στοιχείων, όλα τα μέταλλα μετάπτωσης βρίσκονται μεταξύ των στοιχείων d μπλοκ. Αυτά τα στοιχεία μπλοκ d βρίσκονται μεταξύ των στοιχείων μπλοκ s και των στοιχείων μπλοκ p. Τα στοιχεία του μπλοκ S είναι μέταλλα. Τα στοιχεία του μπλοκ P είναι αμέταλλα. Επομένως, τα στοιχεία d μπλοκ δείχνουν τη μετάβαση των μετάλλων σε αμέταλλα και ονομάζονται μέταλλα μετάπτωσης.
Τα μεταβατικά μέταλλα μπορούν να σχηματίσουν διαφορετικές ενώσεις σε διαφορετικές καταστάσεις οξείδωσης. Όλα τα κατιόντα που σχηματίζονται από μέταλλα μεταπτώσεως είναι πολύχρωμα. Ως εκ τούτου, οι ενώσεις που παράγονται από αυτά τα μέταλλα είναι επίσης πολύ πολύχρωμες. Οι ενώσεις που σχηματίζονται από το ίδιο μεταλλικό στοιχείο μεταπτώσεως βρίσκονται σε διαφορετικά χρώματα. Αυτό συμβαίνει επειδή οι διαφορετικές καταστάσεις οξείδωσης του ίδιου στοιχείου εμφανίζουν διαφορετικά χρώματα.

Εικόνα 1:Χρώματα διαφορετικών συμπλεγμάτων νικελίου
Τα μεταβατικά μέταλλα μπορούν να σχηματίσουν σύνθετες ενώσεις. Ονομάζονται ενώσεις συντονισμού. Το άτομο μετάλλου μετάπτωσης κεντράρεται από αρκετούς συνδέτες που δωρίζουν τα μόνα τους ζεύγη ηλεκτρονίων στο κεντρικό άτομο μετάλλων.
Τι είναι τα μέταλλα εσωτερικής μετάβασης
Τα μέταλλα εσωτερικής μετάπτωσης είναι χημικά στοιχεία που αποτελούνται από ηλεκτρόνια σθένους στα f τροχιακά τους στο προτελευταίο κέλυφος ηλεκτρονίων. Τα στοιχεία μπλοκ F είναι γνωστά ως μέταλλα εσωτερικής μετάπτωσης, καθώς αποτελούνται από ηλεκτρόνια σθένους στα f τροχιακά τους και αυτά τα τροχιακά f περιβάλλονται από άλλα ατομικά τροχιακά.
Η σειρά λανθανιδών και η σειρά ακτινιδών είναι οι δύο περίοδοι του μπλοκ f. Η σειρά λανθανιδών αποτελείται από χημικά στοιχεία που έχουν ηλεκτρόνια σθένους στο τροχιακό τους 4f. Η σειρά ακτινιδών αποτελείται από χημικά στοιχεία που έχουν τα ηλεκτρόνια σθένους τους στο τροχιακό 5f.
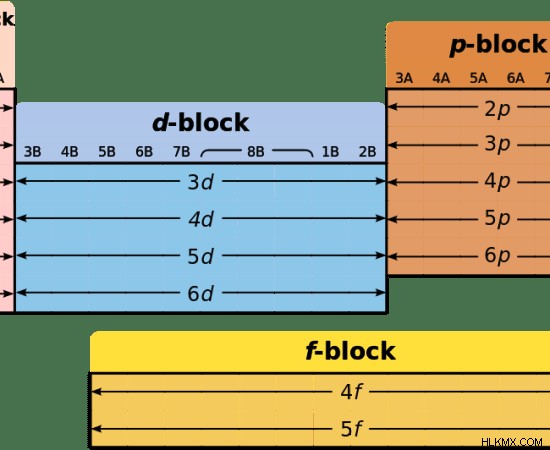
Εικόνα 2:Μπλοκ στον Περιοδικό Πίνακα
Τα εσωτερικά μέταλλα μετάπτωσης αποτελούνται από πολύ μεγάλα άτομα, καθώς έχουν μεγάλο αριθμό κελυφών. Ως εκ τούτου, τα περισσότερα από αυτά είναι ασταθή και ραδιενεργά. Σχεδόν όλες οι ακτινίδες είναι ραδιενεργά στοιχεία, αλλά οι λανθανίδες είναι μη ραδιενεργές με ορισμένες εξαιρέσεις.
Η πιο εμφανής κατάσταση οξείδωσης των εσωτερικών μετάλλων μετάπτωσης είναι +3. Αλλά οι ακτινίδες μπορούν να έχουν έως και +6 κατάσταση οξείδωσης. Τα εσωτερικά μέταλλα μετάπτωσης εμφανίζουν ατομικούς αριθμούς που κυμαίνονται από 57 έως 103.
Διαφορά μεταξύ μετάλλων μετάβασης και μετάλλων εσωτερικής μετάβασης
Ορισμός
Μέταλλα μετάβασης: Τα μέταλλα μετάπτωσης είναι χημικά στοιχεία που αποτελούνται από άτομα που έχουν ασύζευκτα ηλεκτρόνια d, ακόμη και τα σταθερά κατιόντα τους έχουν ασύζευκτα ηλεκτρόνια d.
Μέταλλα εσωτερικής μετάβασης: Τα εσωτερικά μέταλλα μετάπτωσης είναι χημικά στοιχεία που έχουν ηλεκτρόνια σθένους στα f τροχιακά τους στο προτελευταίο κέλυφος ηλεκτρονίων.
Τοποθεσία στον περιοδικό πίνακα
Μέταλλα μετάβασης: Τα μέταλλα μεταπτώσεως βρίσκονται στο μπλοκ d του περιοδικού πίνακα.
Μέταλλα εσωτερικής μετάβασης: Τα εσωτερικά μέταλλα μετάπτωσης βρίσκονται στο μπλοκ f του περιοδικού πίνακα.
Ατομικοί αριθμοί
Μέταλλα μετάβασης: Τα μέταλλα μεταπτώσεως έχουν ατομικούς αριθμούς που κυμαίνονται από 21 έως 112.
Μέταλλα εσωτερικής μετάβασης: Τα εσωτερικά μέταλλα μετάπτωσης έχουν ατομικούς αριθμούς που κυμαίνονται από 57 έως 103.
Αφθονία
Μέταλλα μετάβασης: Τα μεταβατικά μέταλλα είναι άφθονα στη γη.
Μέταλλα εσωτερικής μετάβασης: Τα εσωτερικά μέταλλα μετάπτωσης είναι λιγότερο άφθονα στη γη.
Πιο εξέχουσα κατάσταση οξείδωσης
Μέταλλα μετάβασης: Η πιο εμφανής κατάσταση οξείδωσης των μετάλλων μετάπτωσης είναι +2.
Μέταλλα εσωτερικής μετάβασης: Η πιο εμφανής κατάσταση οξείδωσης των εσωτερικών μετάλλων μετάπτωσης είναι +3.
Συμπέρασμα
Τα μέταλλα μετάπτωσης και τα εσωτερικά μέταλλα μετάπτωσης είναι χημικά στοιχεία που έχουν μεγαλύτερο ατομικό αριθμό και μεγάλα ατομικά μεγέθη. Ως εκ τούτου, τα περισσότερα από αυτά θεωρούνται ως βαρέα μέταλλα. Η κύρια διαφορά μεταξύ των μετάλλων μεταπτώσεως και των εσωτερικών μετάλλων μετάπτωσης είναι ότι τα άτομα μετάλλων μεταπτώσεως έχουν τα ηλεκτρόνια σθένους τους στο εξώτατο d τροχιακό, ενώ τα άτομα του εσωτερικού μετάλλου μετάπτωσης έχουν τα ηλεκτρόνια σθένους στο τροχιακό f του εσωτερικού προτελευταίου κελύφους ηλεκτρονίων.