Διαφορά μεταξύ της σταθεράς του Avogadro και του αριθμού του Avogadro
Κύρια διαφορά – Η Constant του Avogadro εναντίον του Αριθμός του Avogadro
Οι όροι, mole , Αριθμός Avogadro και σταθερά του Avogadro σχετίζονται μεταξύ τους. Το mole είναι μια μονάδα που χρησιμοποιείται για τη μέτρηση της ποσότητας μιας ουσίας. Μπορεί να χρησιμοποιηθεί για τη μέτρηση οποιουδήποτε τύπου χημικής ουσίας. Η τιμή ενός mole είναι 6,022 x 10. Αυτό ονομάζεται αριθμός Avogadro. Ο αριθμός του Avogadro είναι ο αριθμός των σωματιδίων που υπάρχουν σε ένα mole μιας ουσίας. Το mol οποιασδήποτε ουσίας είναι ίσο με αυτόν τον αριθμό σωματιδίων. Αυτά τα σωματίδια μπορεί να είναι άτομα, μόρια, κολλοειδή ή οτιδήποτε άλλο. Επομένως, είναι ένας σταθερός αριθμός που είναι ανεξάρτητος από τον τύπο της ουσίας που θεωρείται και ονομάζεται σταθερά του Avogadro. Η κύρια διαφορά μεταξύ του αριθμού του Avogadro και της σταθεράς του Avogadro είναι ότι Ο αριθμός του Avogadro δίνεται ως αριθμός που δεν έχει μονάδες ενώ η σταθερά του Avogadro δίνεται στη μονάδα ανά mole (mol).
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Avogadro’s Constant
– Ορισμός, Ιστορικό υπόβαθρο, Μονάδες, Εφαρμογές
2. Τι είναι ο αριθμός του Avogadro
– Ορισμός, Ιστορικό υπόβαθρο, Εφαρμογές
3. Ποια είναι η σχέση μεταξύ της σταθεράς του Avogadro και του αριθμού του Avogadro
– Η σταθερά του Avogadro και ο αριθμός του Avogadro
4. Ποια είναι η διαφορά μεταξύ της σταθεράς του Avogadro και του αριθμού του Avogadro
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Avogadro, Avogadro's Constant, Avogadro's Number, Mole 
Τι είναι η Constant του Avogadro
Η σταθερά του Avogadro είναι ο αριθμός των σωματιδίων που υπάρχουν σε ένα mole μιας ουσίας. Αυτό πήρε το όνομά του από τον επιστήμονα Amedeo Avogadro. Αυτή η σταθερά του Avogadro επινοήθηκε επειδή οι επιστήμονες ήθελαν να συσχετίσουν την ποσότητα της μικροσκοπικής ύλης με την ποσότητα της μακροσκοπικής ύλης. Για παράδειγμα, σε μια συγκεκριμένη χημική αντίδραση, η ποσότητα μιας ουσίας που χρησιμοποιείται πρέπει να σχετίζεται με τον αριθμό των ατόμων ή μορίων που υπάρχουν σε αυτήν την ουσία. Μόνο τότε μπορούμε να αναγνωρίσουμε και να προβλέψουμε την ποσότητα του προϊόντος που πρόκειται να δοθεί από αυτήν την αντίδραση.
Η τιμή αυτής της σταθεράς υπολογίστηκε για πρώτη φορά από τον Γερμανό επιστήμονα Jean-Baptiste Perrin. Η τιμή που δόθηκε για τη σταθερά του Avogadro ήταν 6,022 x 10. Σε αυτόν τον αριθμό δόθηκε το όνομα "mole". Ένα mole μιας ουσίας αποτελείται από 6.022 x 10 σωματίδια. Για παράδειγμα, ένα mole Νατρίου αποτελείται από 6.022 x 10 άτομα νατρίου. Ένα mole χλωριούχου νατρίου αποτελείται από 6.022 x 10 μόρια χλωριούχου νατρίου. Επομένως, η μονάδα για τη σταθερά του Avogadro είναι mol. Η σταθερά του Avogadro για ένα mole είναι 6,022 x 10 mol.
Η σταθερά του Avogadro είναι χρήσιμη για τον προσδιορισμό της ποσότητας μιας ουσίας που αντιδρά σε μια συγκεκριμένη χημική αντίδραση. Είναι επίσης χρήσιμο για τον προσδιορισμό της ποσότητας του προϊόντος που δίνεται από αυτήν την αντίδραση. Επιπλέον, μπορούμε επίσης να προβλέψουμε αν αυτή η αντίδραση θα συμβεί ή όχι. Η σταθερά του Avogadro χρησιμοποιείται για τον προσδιορισμό της ατομικής μάζας, της μοριακής μάζας και άλλων σχετικών εννοιών. 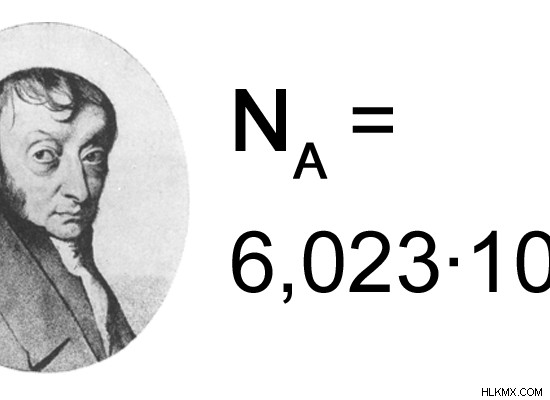
Τι είναι ο αριθμός του Avogadro
Ο αριθμός του Avogadro είναι 6,022 x 10. Είναι η τιμή που δίνεται για τη σταθερά του Avogadro. Το ίδιο πράγμα που αντιπροσωπεύεται από τον αριθμό του Avogadro υπολογίστηκε για πρώτη φορά από έναν Γερμανό επιστήμονα Johann Loschmidt αλλά σε διαφορετικές μονάδες. Ωστόσο, ο πραγματικός αριθμός του Avogadro υπολογίστηκε από τον επιστήμονα Jean-Baptiste Perrin, ο οποίος έδωσε σε αυτήν την τιμή ένα όνομα αριθμός του Avogadro προς τιμήν του Avogadro που έδωσε πρώτος την ιδέα για τον τυφλοπόντικα. Αργότερα, οι έννοιες σχετικά με τον αριθμό του Avogadro αναπτύχθηκαν γρήγορα με την ανάπτυξη της επιστήμης και της τεχνολογίας.
Ένα mole μιας ουσίας αποτελείται από τον αριθμό των σωματιδίων ενός Avogadro. Αυτά τα σωματίδια μπορεί να είναι άτομα, ιόντα, μόρια, κολλοειδή κ.λπ. Το σωματίδιο που εξετάζεται εξαρτάται από τη φύση της ουσίας που εξετάζεται. Αυτός ο όρος είναι χρήσιμος για τον προσδιορισμό των ατομικών μαζών και των μοριακών μαζών, καθώς ο αριθμός του Avogadro υποδηλώνει τον αριθμό των ατόμων που υπάρχουν σε ένα mole ενός χημικού στοιχείου ή τον αριθμό των μορίων που υπάρχουν σε μια συγκεκριμένη ένωση.
Σχέση μεταξύ της σταθεράς του Avogadro και του αριθμού του Avogadro
- Ο αριθμός του Avogadro είναι η τιμή της σταθεράς του Avogadro.
Διαφορά μεταξύ της σταθεράς του Avogadro και του αριθμού του Avogadro
Ορισμός
Η σταθερά του Avogadro: Η σταθερά του Avogadro είναι ο αριθμός των σωματιδίων που υπάρχουν σε ένα mole μιας ουσίας.
Αριθμός Avogadro: Ο αριθμός του Avogadro είναι 6,022 x 10.
Άλλοι ορισμοί
Η σταθερά του Avogadro: Η σταθερά του Avogadro δηλώνει ότι ο αριθμός των βασικών μονάδων που υπάρχουν σε ένα mol μιας συγκεκριμένης ένωσης είναι μια σταθερή τιμή για οποιαδήποτε ένωση.
Αριθμός Avogadro: Ο αριθμός του Avogadro είναι ο αριθμός των ατόμων υδρογόνου που υπάρχουν σε ένα γραμμάριο H ή ο αριθμός των ατόμων άνθρακα που υπάρχουν σε ένα γραμμάριο δείγματος C.
Μονάδες
Η σταθερά του Avogadro: Η σταθερά του Avogadro έχει τη μονάδα mol (ανά mol).
Αριθμός Avogadro: Ο αριθμός του Avogadro δεν έχει μονάδες.
Συμπέρασμα
Τόσο ο αριθμός του Avogadro όσο και η σταθερά του Avogadro περιγράφουν την ίδια έννοια. Και οι δύο αυτές έννοιες περιγράφουν τον αριθμό των σωματιδίων που υπάρχουν σε ένα mole μιας συγκεκριμένης ουσίας. Έχουν την ίδια αξία. Ωστόσο, διαφέρουν μεταξύ τους ανάλογα με τις μονάδες τους. Η κύρια διαφορά μεταξύ του αριθμού του Avogadro και της σταθεράς του Avogadro είναι ότι ο αριθμός του Avogadro δίνεται ως αριθμός που δεν έχει μονάδες ενώ η σταθερά του Avogadro δίνεται στη μονάδα ανά mole (mol).




