Ομόλογα Sigma και Pi
Βασικές έννοιες
Σε αυτό το άρθρο, θα μάθετε για τα βασικά των δεσμών sigma και pi και τη σημασία τους στην οργανική χημεία. Θα έχετε επίσης την ευκαιρία να εφαρμόσετε αυτά που γνωρίζετε με μερικά επεξεργασμένα παραδείγματα.
Θέματα που καλύπτονται σε άλλα άρθρα
- Κβαντικοί αριθμοί και τροχιακά σχήματα
- Αρχή αποκλεισμού Pauli
- Αρχή Aufbau
- Κανόνας του Χουντ
- Προβολές Newman
Βασικά στοιχεία των δεσμών Sigma και Pi
Οι δεσμοί Sigma και pi είναι μια πτυχή της θεωρίας των δεσμών σθένους και της μοριακής τροχιακής θεωρίας που εξηγεί την ύπαρξη διπλών και τριπλών δεσμών. Για να ξεκινήσουμε, πρέπει να εξηγήσουμε και τους δύο δεσμούς:Sigma(σ) και Pi(π). Οι δεσμοί σίγμα σχηματίζονται όταν το διαθέσιμο τροχιακό με την υψηλότερη ενέργεια κάθε ατόμου επικαλύπτει το ένα το άλλο. Η εποικοδομητική αλληλεπίδραση θα οδηγήσει έτσι στο σχηματισμό ενός δεσμού σίγμα μεταξύ των δύο ατόμων με μεγαλύτερη πυκνότητα ηλεκτρονίων κοινή μεταξύ των δύο πυρήνων.

Τυχόν πρόσθετοι δεσμοί μεταξύ δύο ατόμων εξηγούνται με το σχηματισμό δεσμών pi. Αυτό συμβαίνει όταν τα μη υβριδισμένα (γεμισμένα) τροχιακά p κάθε αντίστοιχου ατόμου επικαλύπτονται για να σχηματίσουν υψηλότερη πυκνότητα ηλεκτρονίων μεταξύ των δύο ατόμων εκτός του καθιερωμένου δεσμού σίγμα. Αυτή η συγκόλληση θα δημιουργήσει επίσης ένα αντικολλητικό τροχιακό. Μόλις γεμίσει αυτό το τροχιακό, ο δεσμός μεταξύ των 2 ατόμων σπάει. Συμπερασματικά, οι απλοί δεσμοί μεταξύ των ατόμων έχουν δεσμό σίγμα. τυχόν πρόσθετοι δεσμοί μεταξύ των δύο ατόμων είναι δεσμοί π. Οι διπλοί δεσμοί έχουν δεσμούς 1 sigma και 1 pi και οι τριπλοί δεσμοί έχουν δεσμούς 1 sigma και 2 pi. Αναφερόμενος σε ένα μόριο όπως το διατομικό άζωτο, ο σχηματισμός του N2 θα χρειαζόταν δεσμούς 1 σίγμα και 2 pi μεταξύ των δύο ατόμων αζώτου για να ικανοποιηθεί ο τριπλός δεσμός.
Δεσμοί Pi και Rotamers
Όπως μπορείτε να παρατηρήσετε, οι δεσμοί π σχηματίζουν συνδυασμένα νέφη ηλεκτρονίων που είναι λίγο μετατοπισμένα από τον άξονα μεταξύ των δύο πυρήνων. Αυτό έχει σημαντικές προεκτάσεις για το εν λόγω μόριο με δεσμούς pi.
Συγκεκριμένα, οι απλοί δεσμοί επιτρέπουν την ελεύθερη περιστροφή γύρω από τον άξονα των δύο πυρήνων. Αυτό σημαίνει ότι κάθε άτομο σε έναν μόνο δεσμό μπορεί να περιστρέφεται ανεξάρτητα το ένα από το άλλο. Οι απλοί δεσμοί το επιτρέπουν γιατί έχουν μόνο έναν δεσμό, έναν δεσμό σίγμα, ο οποίος συνδέει τους δύο πυρήνες ακριβώς κατά μήκος του άξονά τους. Οι χημικοί αποκαλούν τους διαφορετικούς προσανατολισμούς που μπορούν να έχουν αυτά τα άτομα σε σχέση μεταξύ τους περιστροφικά, τα οποία έχουν μεγάλη σημασία στην οργανική χημεία. Συχνά αυτή η περιστροφή μπορεί να συμβεί πολύ γρήγορα. Το αιθάνιο, για παράδειγμα, ολοκληρώνει 10 πλήρεις περιστροφές γύρω από τον δεσμό C-C ανά δευτερόλεπτο.
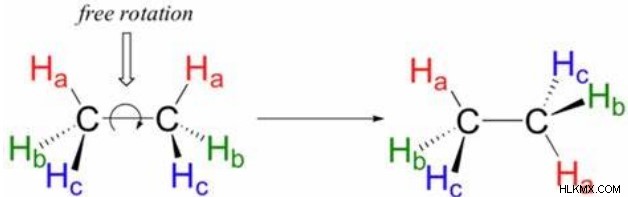
Ωστόσο, μόλις σχηματιστεί ένας δεσμός pi μεταξύ δύο ατόμων, κάθε ελεύθερη περιστροφή σταματά. Λόγω της μετατόπισης του νέφους ηλεκτρονίων pi, οποιαδήποτε αλλαγή στον προσανατολισμό μεταξύ των ατόμων μειώνει την τροχιακή επικάλυψη. Αυτό σημαίνει ότι οι ομάδες που συνδέονται με τα άτομα που συμμετέχουν στον δεσμό pi έχουν σταθερό σχετικό προσανατολισμό. Οι διαφορετικοί πιθανοί προσανατολισμοί (πριν από το σχηματισμό του δεσμού pi) ονομάζονται επίσης "rotamers", αν και μερικές φορές ονομάζονται "γεωμετρικά ισομερή".
Ο 4ος δεσμός;
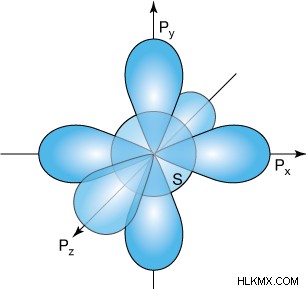
Η επικάλυψη μη υβριδοποιημένων γεμισμένων τροχιακών p σχηματίζει δεσμούς π. Είναι σημαντικό να σημειωθεί ότι ο προσανατολισμός τους είναι ορθογώνιος, καθώς και μετατοπισμένος κάπως, στον αρχικό δεσμό σίγμα και παράλληλος με το τροχιακό p του άλλου ατόμου. Σε αντίθεση με τους κανονικούς δεσμούς σίγμα που μπορούν να περιστρέφονται ελεύθερα, η προσθήκη δεσμών pi εμποδίζει την περιστροφή ενός δεσμού. Όπως μπορείτε να καταλάβετε από την εικόνα, μόνο 2 από τα 3 τροχιακά p μπορούν να είναι κάθετα στον δεσμό σ. Αυτό σημαίνει ότι το τρίτο από τα τροχιακά p είναι παράλληλο σε έναν δεδομένο δεσμό σίγμα και έτσι το άτομο θα απαιτήσει την κλήση του τροχιακού d για να σχηματίσει τετραπλούς δεσμούς. Επιπλέον, για να περιστραφεί ένα άτομο γύρω από έναν διπλό δεσμό, οι δεσμοί pi πρέπει πρώτα να σπάσουν.
Πρακτική:Προσδιορίστε τον αριθμό των δεσμών σίγμα και π.
1:Πόσοι δεσμοί σ και π υπάρχουν στο Αιθίνιο;

2:Πόσοι δεσμοί σ και π υπάρχουν στη γλυκόζη;

3:Πόσοι δεσμοί σ και π υπάρχουν στο σαλικυλικό οξύ;

Απαντήσεις:
1:Το αιθίνιο σχηματίζει 3 σ και 2 π δεσμούς
2:Η γλυκόζη σχηματίζει 29 δεσμούς σ
3:Το σαλικυλικό οξύ σχηματίζει δεσμούς 12 σ και 4 π




