Διαφορά μεταξύ αυθόρμητων και μη αυθόρμητων αντιδράσεων
Κύρια διαφορά – Αυθόρμητες έναντι Μη Αυθόρμητες Αντιδράσεις
Οι αυθόρμητες και οι μη αυθόρμητες αντιδράσεις είναι οι δύο τύποι χημικών αντιδράσεων που μπορούν να συμβούν στο περιβάλλον. Οι αυθόρμητες αντιδράσεις λαμβάνουν χώρα από μόνες τους κάτω από ένα δεδομένο σύνολο συνθηκών. Ωστόσο, θα πρέπει να παρέχεται ενέργεια για να προχωρήσουν οι μη αυθόρμητες αντιδράσεις. Η αλλαγή στην ελεύθερη ενέργεια Gibbs είναι αρνητική για αυθόρμητες αντιδράσεις. Επομένως, αυτές οι αντιδράσεις απελευθερώνουν ενέργεια στο περιβάλλον με τη μορφή θερμότητας. Σε μη αυθόρμητες αντιδράσεις, η αλλαγή στην ελεύθερη ενέργεια Gibbs είναι θετική. Απορροφούν ενέργεια από το περιβάλλον. Για το λόγο αυτό, οι αυθόρμητες αντιδράσεις είναι εξεργογικές ενώ οι μη αυθόρμητες αντιδράσεις είναι ενδοργικές. Η κύρια διαφορά μεταξύ αυθόρμητων και μη αυθόρμητων αντιδράσεων είναι ότι οι αυθόρμητες αντιδράσεις απελευθερώνουν ελεύθερη ενέργεια από το σύστημα, καθιστώντας το πιο σταθερό ενώ οι μη αυθόρμητες αντιδράσεις αυξάνουν τη συνολική ενέργεια του συστήματος .
Βασικές περιοχές που καλύπτονται
1. Τι είναι οι Αυθόρμητες Αντιδράσεις
– Ορισμός, Θερμοδυναμική, Παραδείγματα
2. Τι είναι οι μη αυθόρμητες αντιδράσεις
– Ορισμός, Θερμοδυναμική, Παραδείγματα
3. Ποιες είναι οι ομοιότητες μεταξύ αυθόρμητων και μη αυθόρμητων αντιδράσεων
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά μεταξύ αυθόρμητων και μη αυθόρμητων αντιδράσεων
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ενεργονικές αντιδράσεις, Εντροπία, Εξεργονικές Αντιδράσεις, Ελεύθερη Ενέργεια Gibbs, Μη Αυθόρμητες Αντιδράσεις, Αυθόρμητες Αντιδράσεις

Τι είναι οι αυθόρμητες αντιδράσεις
Οι αυθόρμητες αντιδράσεις αναφέρονται στις χημικές αντιδράσεις που συμβαίνουν χωρίς να οδηγούνται από εξωτερική δύναμη. Οι δύο κινητήριες δυνάμεις μιας χημικής αντίδρασης είναι η ενθαλπία και η εντροπία. Η ενθαλπία είναι μια θερμοδυναμική ιδιότητα ενός συστήματος που είναι το άθροισμα της εσωτερικής ενέργειας που προστίθεται στο γινόμενο της πίεσης και του όγκου του συστήματος. Η εντροπία είναι η άλλη θερμοδυναμική ιδιότητα που αντιπροσωπεύει τη θερμική ενέργεια του συστήματος ανά μονάδα θερμοκρασίας. Περιγράφει την τυχαιότητα και την αταξία των μορίων. Όταν η εμφάνιση μιας χημικής αντίδρασης μειώνει την ενθαλπία και αυξάνει την εντροπία του συστήματος, θεωρείται ευνοϊκή αντίδραση. Καθώς οι αυθόρμητες αντιδράσεις πληρούν τις δύο παραπάνω προϋποθέσεις, συμβαίνουν χωρίς εσωτερική παρέμβαση.

Εικόνα 1:Καύση ξύλου
Η καύση είναι ένα παράδειγμα αυθόρμητων αντιδράσεων. Τα προϊόντα της φωτιάς αποτελούνται εν μέρει από τα δύο αέρια:διοξείδιο του άνθρακα και υδρατμούς. Η καύση παράγει θερμότητα. Επομένως, είναι μια εξεργολογική αντίδραση. Η θερμότητα αυξάνει την εντροπία του συστήματος. Όμως, η εντροπία των προϊόντων της καύσης έχει μειωμένη εντροπία.
Τι είναι οι μη αυθόρμητες αντιδράσεις
Οι μη αυθόρμητες αντιδράσεις αναφέρονται στις χημικές αντιδράσεις που απαιτούν εισροή ενέργειας για να προχωρήσουν. Σε μη αυθόρμητες αντιδράσεις, τόσο η ενθαλπία όσο και η εντροπία προτιμούν τα αντιδρώντα. Έτσι, τα αντιδρώντα είναι πιο σταθερά από τα προϊόντα. Για το λόγο αυτό, η χημική αντίδραση είναι ενδρογόνος, απορροφώντας θερμότητα. Μειώνει επίσης την εντροπία. Η αλλαγή της ελεύθερης ενέργειας Gibbs με την πάροδο του χρόνου σε μη αυθόρμητες αντιδράσεις φαίνεται στο σχήμα 2.
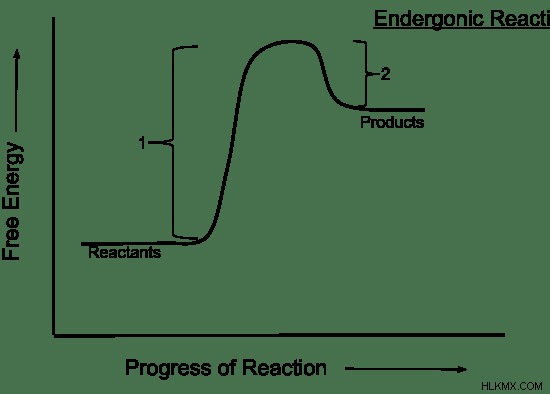
Εικόνα 2:Η αλλαγή της ελεύθερης ενέργειας/χρόνου Gibbs
Η αντίδραση μεταξύ ατμοσφαιρικού αζώτου και οξυγόνου είναι ένα παράδειγμα μη αυθόρμητης αντίδρασης. Σχηματίζει μονοξείδιο του αζώτου. Στην κανονική ατμοσφαιρική πίεση και θερμοκρασία, αυτή η αντίδραση είναι δυσμενής. Αυτό σημαίνει ότι τα αντιδρώντα της χημικής αντίδρασης, δηλαδή το άζωτο και τα αέρια οξυγόνου, είναι πιο σταθερά από το προϊόν:το μονοξείδιο του αζώτου. Όμως, σε πολύ υψηλές θερμοκρασίες, όπως όταν κεραυνοί, αυτή η αντίδραση είναι ευνοϊκή.
Ομοιότητες μεταξύ αυθόρμητων και μη αυθόρμητων αντιδράσεων
- Στο περιβάλλον συμβαίνουν τόσο αυθόρμητες όσο και μη αυθόρμητες αντιδράσεις.
- Τόσο οι αυθόρμητες όσο και οι μη αυθόρμητες αντιδράσεις συμβαίνουν σε ένα σύστημα με καθορισμένα όρια.
- Τόσο οι αυθόρμητες όσο και οι μη αυθόρμητες αντιδράσεις υπακούουν στους τρεις νόμους της θερμοδυναμικής.
Διαφορά μεταξύ αυθόρμητων και μη αυθόρμητων αντιδράσεων
Ορισμός
Αυθόρμητες αντιδράσεις: Οι αυθόρμητες αντιδράσεις αναφέρονται στις χημικές αντιδράσεις που συμβαίνουν χωρίς να οδηγούνται από εξωτερική δύναμη.
Μη αυθόρμητες αντιδράσεις: Οι μη αυθόρμητες αντιδράσεις αναφέρονται στις χημικές αντιδράσεις που απαιτούν εισροή ενέργειας για να προχωρήσουν.
Ευνοϊκό/Μη ευνοϊκό
Αυθόρμητες αντιδράσεις: Οι αυθόρμητες αντιδράσεις είναι ευνοϊκές.
Μη αυθόρμητες αντιδράσεις: Οι μη αυθόρμητες αντιδράσεις είναι δυσμενείς.
Εισαγωγή ενέργειας
Αυθόρμητες αντιδράσεις: Οι αυθόρμητες αντιδράσεις δεν απαιτούν εισροή ενέργειας για να προχωρήσουν κάτω από ένα σύνολο συνθηκών.
Μη αυθόρμητες αντιδράσεις: Οι μη αυθόρμητες αντιδράσεις απαιτούν εισροή ενέργειας για να προχωρήσουν.
Αλλαγή στην ελεύθερη ενέργεια Gibbs
Αυθόρμητες αντιδράσεις: Η μεταβολή της ελεύθερης ενέργειας Gibbs σε μια αυθόρμητη αντίδραση είναι αρνητική (ΔG° <0).
Μη αυθόρμητες αντιδράσεις: Η αλλαγή στην ελεύθερη ενέργεια Gibbs σε μια μη αυθόρμητη αντίδραση είναι θετική (ΔG°> 0).
Συνολική ενέργεια του συστήματος
Αυθόρμητες αντιδράσεις: Οι αυθόρμητες αντιδράσεις απελευθερώνουν την ελεύθερη ενέργεια από το σύστημα, καθιστώντας το πιο σταθερό.
Μη αυθόρμητες αντιδράσεις: Οι μη αυθόρμητες αντιδράσεις αυξάνουν τη συνολική ενέργεια του συστήματος.
Συνολική ενέργεια των προϊόντων
Αυθόρμητες αντιδράσεις: Η συνολική ενέργεια των προϊόντων μιας αυθόρμητης αντίδρασης είναι μικρότερη από αυτή των αντιδρώντων.
Μη αυθόρμητες αντιδράσεις: Η συνολική ενέργεια των προϊόντων μιας μη αυθόρμητης αντίδρασης είναι υψηλότερη από αυτή των αντιδρώντων.
Ενθαλπία
Αυθόρμητες αντιδράσεις: Οι αυθόρμητες αντιδράσεις έχουν αρνητική ενθαλπία.
Μη αυθόρμητες αντιδράσεις: Οι μη αυθόρμητες αντιδράσεις έχουν θετική ενθαλπία.
Εξεργονικές/Ενεργονικές αντιδράσεις
Αυθόρμητες αντιδράσεις: Οι αυθόρμητες αντιδράσεις είναι εξεργογικές αντιδράσεις.
Μη αυθόρμητες αντιδράσεις: Οι μη αυθόρμητες αντιδράσεις είναι ενδοργικές αντιδράσεις.
Εντροπία
Αυθόρμητες αντιδράσεις: Οι αυθόρμητες αντιδράσεις αυξάνουν την εντροπία.
Μη αυθόρμητες αντιδράσεις: Οι μη αυθόρμητες αντιδράσεις μειώνουν την εντροπία.
Ταχύτητα αντίδρασης
Αυθόρμητες αντιδράσεις: Οι αυθόρμητες αντιδράσεις εμφανίζονται γρήγορα.
Μη αυθόρμητες αντιδράσεις: Οι μη αυθόρμητες αντιδράσεις συμβαίνουν με μικρότερη ταχύτητα.
Παραδείγματα
Αυθόρμητες αντιδράσεις: Οι αντιδράσεις καύσης είναι αυθόρμητες.
Μη αυθόρμητες αντιδράσεις: Η αντίδραση μεταξύ ατμοσφαιρικού αζώτου και οξυγόνου είναι ένα παράδειγμα μη αυθόρμητης αντίδρασης.
Συμπέρασμα
Οι αυθόρμητες και οι μη αυθόρμητες αντιδράσεις είναι οι δύο τύποι χημικών αντιδράσεων που συμβαίνουν στο περιβάλλον. Οι αυθόρμητες αντιδράσεις είναι εξωργικές. Έτσι, μειώνουν την ενθαλπία και αυξάνουν την εντροπία του συστήματος. Ωστόσο, οι μη αυθόρμητες αντιδράσεις είναι ενδογενείς. Αυξάνουν την ενθαλπία του συστήματος καθώς απαιτούν εξωτερική εισροή ενέργειας για να προχωρήσουν. Μειώνουν επίσης την εντροπία. Για το λόγο αυτό, οι αυθόρμητες αντιδράσεις είναι ευνοϊκές κάτω από ένα δεδομένο σύνολο χημικών αντιδράσεων. Όμως, οι μη αυθόρμητες αντιδράσεις είναι δυσμενείς. Η κύρια διαφορά μεταξύ αυθόρμητων και μη αυθόρμητων αντιδράσεων είναι οι θερμοδυναμικές ιδιότητες κάθε τύπου αντίδρασης.
Αναφορά:
1. «Οι νόμοι της θερμοδυναμικής». Οι Νόμοι της Θερμοδυναμικής | Απεριόριστη Χημεία, Διαθέσιμο εδώ.
2. "11.5:Αυθόρμητες αντιδράσεις και ελεύθερη ενέργεια." Chemistry LibreTexts, Libretexts, 1 Νοεμβρίου 2017, Διαθέσιμο εδώ.
3. «Ενεργονική αντίδραση». Wikipedia, Ίδρυμα Wikimedia, 16 Δεκεμβρίου 2017, Διαθέσιμο εδώ.
Εικόνα Ευγενική προσφορά:
1. “Large bonfire” By Fir0002 – Αρχικά ανέβηκε στην αγγλική Wikipedia εδώ από τον συγγραφέα (CC BY-SA 3.0) μέσω του Commons Wikimedia
2. "Endergonic Reaction" By Provenzano15 – Δική του δουλειά (CC BY-SA 3.0) μέσω Commons Wikimedia