Διαφορά μεταξύ συγγένειας ηλεκτρονίων και ενέργειας ιοντισμού
Κύρια διαφορά – Συγγένεια ηλεκτρονίων έναντι ενέργειας ιοντισμού
Τα ηλεκτρόνια είναι υποατομικά σωματίδια ατόμων. Υπάρχουν πολλές χημικές έννοιες που εξηγούν τη συμπεριφορά των ηλεκτρονίων. Η συγγένεια ηλεκτρονίων και η ενέργεια ιονισμού είναι δύο τέτοιες έννοιες στη χημεία. Η συγγένεια ηλεκτρονίων είναι η ποσότητα ενέργειας που απελευθερώνεται όταν ένα ουδέτερο άτομο ή μόριο αποκτά ένα ηλεκτρόνιο. Η συγγένεια ηλεκτρονίων μπορεί να είναι επίσης γνωστή ως ενθαλπία κέρδους ηλεκτρονίων όταν λαμβάνεται υπόψη η έννοια, αλλά είναι διαφορετικοί όροι αφού η ενθαλπία κέρδους ηλεκτρονίων περιγράφει την ποσότητα ενέργειας που απορροφάται από το περιβάλλον όταν ένα άτομο αποκτά ένα ηλεκτρόνιο. Η ενέργεια ιονισμού, από την άλλη πλευρά, είναι η ποσότητα ενέργειας που απαιτείται για την απομάκρυνση ενός ηλεκτρονίου από ένα άτομο. Η κύρια διαφορά μεταξύ της συγγένειας ηλεκτρονίων και της ενέργειας ιοντισμού είναι ότι η συγγένεια ηλεκτρονίων δίνει την ποσότητα ενέργειας που απελευθερώνεται όταν ένα άτομο αποκτά ένα ηλεκτρόνιο, ενώ η ενέργεια ιονισμού είναι η ποσότητα ενέργειας που απαιτείται για την αφαίρεση ενός ηλεκτρονίου από ένα άτομο.
Βασικές περιοχές που καλύπτονται
1. Τι είναι η συγγένεια ηλεκτρονίων
– Ορισμός, Ενδόθερμες και Εξώθερμες Αντιδράσεις
2. Τι είναι η Ενέργεια Ιονισμού
– Ορισμός, Πρώτος Ιονισμός, Δεύτερος Ιονισμός
3. Ποιες είναι οι ομοιότητες μεταξύ της συγγένειας των ηλεκτρονίων και της ενέργειας ιονισμού
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά μεταξύ συγγένειας ηλεκτρονίων και ενέργειας ιονισμού
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Άτομο, ηλεκτρόνιο, συγγένεια ηλεκτρονίων, ενθαλπία απολαβής ηλεκτρονίων, ενέργεια πρώτου ιονισμού, ενέργεια ιοντισμού, ενέργεια δεύτερης ιονισμού

Τι είναι η συγγένεια ηλεκτρονίων
Η συγγένεια ηλεκτρονίων είναι η ποσότητα ενέργειας που απελευθερώνεται όταν ένα ουδέτερο άτομο ή ένα μόριο (στην αέρια φάση) αποκτά ένα ηλεκτρόνιο από το εξωτερικό. Αυτή η προσθήκη ηλεκτρονίων προκαλεί το σχηματισμό ενός αρνητικά φορτισμένου χημικού είδους. Αυτό μπορεί να αναπαρασταθεί με σύμβολα ως εξής.
X + e → X + ενέργεια
Η προσθήκη ενός ηλεκτρονίου σε ένα ουδέτερο άτομο ή ένα μόριο απελευθερώνει ενέργεια. Αυτό ονομάζεται εξώθερμη αντίδραση. Αυτή η αντίδραση οδηγεί σε ένα αρνητικό ιόν. Αλλά εάν ένα άλλο ηλεκτρόνιο πρόκειται να προστεθεί σε αυτό το αρνητικό ιόν, θα πρέπει να δοθεί ενέργεια για να προχωρήσουμε σε αυτήν την αντίδραση. Αυτό συμβαίνει επειδή το εισερχόμενο ηλεκτρόνιο απωθείται από τα άλλα ηλεκτρόνια. Αυτό το φαινόμενο ονομάζεται ενδόθερμη αντίδραση.
Επομένως, οι πρώτες συγγένειες ηλεκτρονίων είναι αρνητικές τιμές και οι δεύτερες τιμές συγγένειας ηλεκτρονίων του ίδιου είδους είναι θετικές τιμές.
Συνάφεια πρώτου ηλεκτρονίου: X(g) + e → X(g)
Συγγένεια δεύτερου ηλεκτρονίου: X (g) + e → X (g)
Η συγγένεια ηλεκτρονίων δείχνει περιοδικές διακυμάνσεις στον περιοδικό πίνακα. Αυτό συμβαίνει επειδή το εισερχόμενο ηλεκτρόνιο προστίθεται στο εξώτατο τροχιακό ενός ατόμου. Τα στοιχεία του περιοδικού πίνακα είναι διατεταγμένα σύμφωνα με την αύξουσα σειρά του ατομικού τους αριθμού. Όταν αυξάνεται ο ατομικός αριθμός, αυξάνεται ο αριθμός των ηλεκτρονίων που έχουν στα εξωτερικά τροχιακά τους.
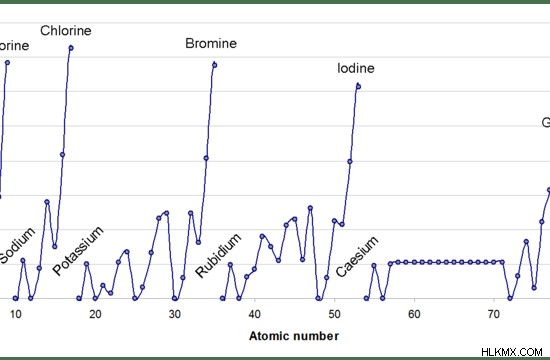
Εικόνα 1:Μεταβολή της συγγένειας ηλεκτρονίων κατά μήκος μιας περιόδου περιοδικού πίνακα
Γενικά, η συγγένεια ηλεκτρονίων θα πρέπει να αυξάνεται κατά την περίοδο από αριστερά προς τα δεξιά, επειδή ο αριθμός των ηλεκτρονίων αυξάνεται κατά τη διάρκεια μιας περιόδου. Έτσι, είναι δύσκολο να προστεθεί ένα νέο ηλεκτρόνιο. Όταν αναλύονται πειραματικά, οι τιμές συγγένειας ηλεκτρονίων δείχνουν ένα μοτίβο ζιγκ-ζαγκ και όχι ένα μοτίβο που δείχνει μια σταδιακή αύξηση.
Τι είναι η Ενέργεια Ιονισμού
Η ενέργεια ιοντισμού είναι η ποσότητα ενέργειας που χρειάζεται ένα αέριο άτομο για να αφαιρέσει ένα ηλεκτρόνιο από το εξώτατο τροχιακό του. Αυτό ονομάζεται ενέργεια ιοντισμού επειδή το άτομο παίρνει θετικό φορτίο μετά την απομάκρυνση ενός ηλεκτρονίου και γίνεται θετικά φορτισμένο ιόν. Κάθε χημικό στοιχείο έχει μια συγκεκριμένη ενεργειακή τιμή ιονισμού αφού τα άτομα ενός στοιχείου είναι διαφορετικά από τα άτομα ενός άλλου στοιχείου. Για παράδειγμα, η πρώτη και η δεύτερη ενέργεια ιονισμού περιγράφουν την ποσότητα ενέργειας που απαιτείται από ένα άτομο για να αφαιρέσει ένα ηλεκτρόνιο και ένα άλλο ηλεκτρόνιο, αντίστοιχα.
Πρώτη ενέργεια ιοντισμού
Η ενέργεια πρώτου ιονισμού είναι η ποσότητα ενέργειας που απαιτείται από ένα αέριο, ουδέτερο άτομο για να αφαιρέσει το εξώτατο ηλεκτρόνιό του. Αυτό το εξώτατο ηλεκτρόνιο βρίσκεται στο εξώτατο τροχιακό ενός ατόμου. Επομένως, αυτό το ηλεκτρόνιο έχει την υψηλότερη ενέργεια μεταξύ άλλων ηλεκτρονίων αυτού του ατόμου. Ως εκ τούτου, η πρώτη ενέργεια ιονισμού είναι η ενέργεια που απαιτείται για την εκκένωση του ηλεκτρονίου υψηλότερης ενέργειας από ένα άτομο. Αυτή η αντίδραση είναι ουσιαστικά μια ενδόθερμη αντίδραση.
Αυτή η έννοια σχετίζεται με ένα ουδέτερα φορτισμένο άτομο, καθώς τα ουδέτερα φορτισμένα άτομα αποτελούνται μόνο από τον αρχικό αριθμό ηλεκτρονίων από τα οποία θα πρέπει να αποτελείται το στοιχείο. Ωστόσο, η ενέργεια που απαιτείται για το σκοπό αυτό εξαρτάται από τον τύπο του στοιχείου. Εάν όλα τα ηλεκτρόνια είναι ζευγαρωμένα σε ένα άτομο, απαιτεί υψηλότερη ενέργεια. Εάν υπάρχει ένα ασύζευκτο ηλεκτρόνιο, απαιτεί μικρότερη ενέργεια. Ωστόσο, η αξία εξαρτάται και από κάποια άλλα στοιχεία. Για παράδειγμα, εάν η ατομική ακτίνα είναι υψηλή, απαιτείται χαμηλή ποσότητα ενέργειας, καθώς το εξώτατο ηλεκτρόνιο βρίσκεται μακριά από τον πυρήνα. Τότε η δύναμη έλξης μεταξύ αυτού του ηλεκτρονίου και του πυρήνα είναι χαμηλή. Επομένως, μπορεί εύκολα να αφαιρεθεί. Αλλά εάν η ατομική ακτίνα είναι χαμηλή, τότε το ηλεκτρόνιο έλκεται σε μεγάλο βαθμό από τον πυρήνα και είναι δύσκολο να αφαιρεθεί το ηλεκτρόνιο από το άτομο.
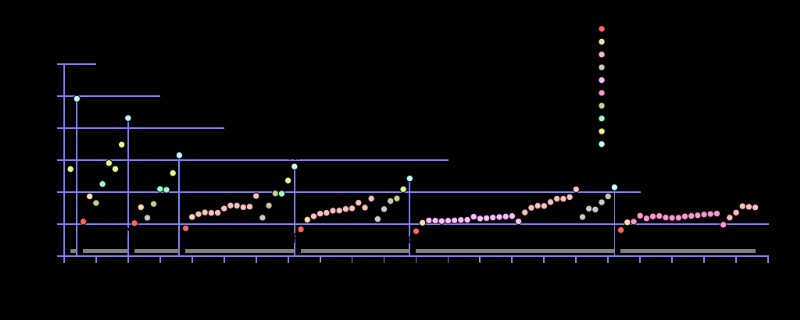
Εικόνα 2:Μοτίβο μεταβαλλόμενων πρώτων ιονιστικών ενεργειών ορισμένων χημικών στοιχείων
Δεύτερη ενέργεια ιοντισμού
Η δεύτερη ενέργεια ιονισμού μπορεί να οριστεί ως η ποσότητα ενέργειας που απαιτείται για την αφαίρεση ενός εξώτατου ηλεκτρονίου από ένα αέριο, θετικά φορτισμένο άτομο. Η απομάκρυνση ενός ηλεκτρονίου από ένα ουδέτερα φορτισμένο άτομο έχει ως αποτέλεσμα θετικό φορτίο. Αυτό συμβαίνει επειδή δεν υπάρχουν αρκετά ηλεκτρόνια για να εξουδετερώσουν το θετικό φορτίο του πυρήνα. Η αφαίρεση ενός άλλου ηλεκτρονίου από αυτό το θετικά φορτισμένο άτομο θα απαιτήσει πολύ υψηλή ενέργεια. Αυτή η ποσότητα ενέργειας ονομάζεται δεύτερη ενέργεια ιονισμού.
Η δεύτερη ενέργεια ιοντισμού είναι πάντα υψηλότερη από την πρώτη ενέργεια ιοντισμού, καθώς είναι πολύ δύσκολο να αφαιρεθεί ένα ηλεκτρόνιο από ένα θετικά φορτισμένο άτομο παρά από ένα ουδέτερα φορτισμένο άτομο. Αυτό συμβαίνει επειδή τα υπόλοιπα ηλεκτρόνια έλκονται σε μεγάλο βαθμό από τον πυρήνα μετά την αφαίρεση ενός ηλεκτρονίου από ένα ουδέτερο άτομο.
Ομοιότητες μεταξύ συγγένειας ηλεκτρονίων και ενέργειας ιοντισμού
- Και οι δύο είναι όροι που σχετίζονται με την ενέργεια.
- Η τιμή τόσο της συγγένειας των ηλεκτρονίων όσο και της ενέργειας ιοντισμού εξαρτάται από τη διαμόρφωση ηλεκτρονίων του υποκείμενου ατόμου.
- Και τα δύο δείχνουν ένα μοτίβο στον περιοδικό πίνακα.
Διαφορά μεταξύ συγγένειας ηλεκτρονίων και ενέργειας ιονισμού
Ορισμός
Συγγένεια ηλεκτρονίων: Η συγγένεια ηλεκτρονίων είναι η ποσότητα ενέργειας που απελευθερώνεται όταν ένα ουδέτερο άτομο ή μόριο (στην αέρια φάση) αποκτά ένα ηλεκτρόνιο από το εξωτερικό.
Ενέργεια ιονισμού: Η ενέργεια ιοντισμού είναι η ποσότητα ενέργειας που χρειάζεται ένα αέριο άτομο για να αφαιρέσει ένα ηλεκτρόνιο από το εξώτατο τροχιακό του.
Ενέργεια
Συγγένεια ηλεκτρονίων: Η συγγένεια ηλεκτρονίων περιγράφει την απελευθέρωση ενέργειας στο περιβάλλον.
Ενέργεια ιονισμού: Η ενέργεια ιονισμού περιγράφει την απορρόφηση ενέργειας από το εξωτερικό.
Ενέργεια ηλεκτρονίων
Συγγένεια ηλεκτρονίων: Η συγγένεια ηλεκτρονίων χρησιμοποιείται για να περιγράψει την απόκτηση ηλεκτρονίων.
Ενέργεια ιονισμού: Η ενέργεια ιονισμού χρησιμοποιείται για να περιγράψει την αφαίρεση ηλεκτρονίων.
Συμπέρασμα
Η συγγένεια ηλεκτρονίων και η ενέργεια ιονισμού είναι δύο χημικοί όροι που χρησιμοποιούνται για να περιγράψουν τη συμπεριφορά των ηλεκτρονίων και του ατόμου ποσοτικά. Η κύρια διαφορά μεταξύ της συγγένειας ηλεκτρονίων και της ενέργειας ιοντισμού είναι ότι η συγγένεια ηλεκτρονίων δίνει την ποσότητα ενέργειας που απελευθερώνεται όταν ένα άτομο αποκτά ένα ηλεκτρόνιο, ενώ η ενέργεια ιονισμού είναι η ποσότητα ενέργειας που απαιτείται για την απομάκρυνση ενός ηλεκτρονίου από ένα άτομο.
Αναφορά:
1. «Συγγένεια ηλεκτρονίων». Chemistry LibreTexts, Libretexts, 14 Νοεμβρίου 2017, Διαθέσιμο εδώ.
2. Electron Affinity, Chem Guide, Διατίθεται εδώ.
3. Helmenstine, Anne Marie. «Ορισμός και τάση ιονισμού ενέργειας». ThoughtCo, 10 Φεβρουαρίου 2017, Διαθέσιμο εδώ.
Εικόνα Ευγενική προσφορά:
1. «Συγγένειες ηλεκτρονίων των στοιχείων» Από Sandbh – Δική μου εργασία (CC BY-SA 3.0) μέσω Commons Wikimedia
2. “First Ionization Energy” By Sponk (αρχείο PNG)Glrx (αρχείο SVG)Wylve (zh-Hans, zh-Hant)Palosirkka (fi)Michel Djerzinski (vi)TFerenczy (cz)Obsuser (sr-EC, sr-EL, hr , bs, sh)DePiep (στοιχεία 104–108)Bob Saint Clar (fr)Shizhao (zh-Hans)Wiki LIC (es)Agung karjono (id)Szaszicska (hu) – Δική δουλειά βασισμένη σε:Erste Ionisierungsenergie PSE χρωματική κωδικοποίηση. png από Sponk (CC BY 3.0) μέσω Commons Wikimedia