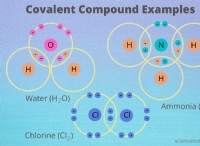
Πώς να χωρίσετε ένα μόριο νερού
Η ηλεκτρόλυση είναι η διαδικασία χρήσης ηλεκτρικής ενέργειας για τη διάσπαση του νερού σε υδρογόνο και αέριο οξυγόνου. Αυτή η διαδικασία είναι η πιο συχνά χρησιμοποιούμενη μέθοδος για τη διαίρεση του νερού και είναι σχετικά απλή. Απλά περάστε ένα ηλεκτρικό ρεύμα μέσω του νερού και τα άτομα υδρογόνου και οξυγόνου θα διαχωριστούν. Τα άτομα υδρογόνου θα συλλέγονται στο αρνητικό ηλεκτρόδιο και τα άτομα οξυγόνου θα συλλέγονται στο θετικό ηλεκτρόδιο.
2.) Ηλιακή ενέργεια
Η ηλιακή ενέργεια μπορεί επίσης να χρησιμοποιηθεί για τη διάσπαση του νερού. Αυτή η διαδικασία ονομάζεται φωτόλυση και εμφανίζεται όταν το φως του ήλιου χτυπά τα μόρια του νερού και χτυπά τα ηλεκτρόνια από τα άτομα υδρογόνου. Τα άτομα υδρογόνου στη συνέχεια θα συλλεχθούν στο αρνητικό ηλεκτρόδιο και τα άτομα οξυγόνου θα συλλέγονται στο θετικό ηλεκτρόδιο.
3.) Υψηλή θερμοκρασία
Το νερό μπορεί επίσης να χωριστεί χρησιμοποιώντας υψηλές θερμοκρασίες. Αυτή η διαδικασία ονομάζεται θερμοχημική διάσπαση νερού και εμφανίζεται όταν τα μόρια του νερού θερμαίνονται σε πολύ υψηλές θερμοκρασίες (πάνω από 2.000 βαθμοί Κελσίου). Οι υψηλές θερμοκρασίες προκαλούν τη διάσπαση των μορίων νερού σε υδρογόνο και αέριο οξυγόνου.
4.) Φωτοκαταθήκη
Η φωτοκατάλυση είναι μια διαδικασία που χρησιμοποιεί ελαφριά ενέργεια για να χωρίσει το νερό. Αυτή η διαδικασία συμβαίνει όταν ένα υλικό ημιαγωγού εκτίθεται στο φως. Η φωτεινή ενέργεια διεγείρει τα ηλεκτρόνια του ημιαγωγού και τα ηλεκτρόνια στη συνέχεια χρησιμοποιούνται για τη διάσπαση των μορίων νερού σε υδρογόνο και αέριο οξυγόνου.
5.) Βιολογικές διεργασίες
Ορισμένοι τύποι βακτηρίων μπορούν να χωρίσουν το νερό χρησιμοποιώντας μια διαδικασία γνωστή ως βακτηριακή φωτοσύνθεση. Αυτή η διαδικασία συμβαίνει όταν τα βακτήρια χρησιμοποιούν το ηλιακό φως για να μετατρέψουν το διοξείδιο του άνθρακα και το νερό σε οργανική ύλη. Τα άτομα υδρογόνου στο νερό απελευθερώνονται ως αέριο υδρογόνου.
6) Supercritical Water
Το νερό μπορεί να χωριστεί σε υδρογόνο και οξυγόνο θέρμανσης σε μια υπερκρίσιμη κατάσταση, η οποία είναι πάνω από την κρίσιμη θερμοκρασία (374 ° C) και την κρίσιμη πίεση (218 atm) νερού. Σε αυτή την κατάσταση, το νερό χάνει την υγρή δομή του και γίνεται ένα πυκνό, φυσικό υγρό ικανό να διαλύσει διάφορες ουσίες. Όταν το υπερκρίσιμο νερό υποβάλλεται σε υψηλές πιέσεις και θερμοκρασίες, οι δεσμοί μεταξύ των ατόμων υδρογόνου και οξυγόνου αποδυναμώνουν και σπάσουν, οδηγώντας στον σχηματισμό αερίων υδρογόνου και οξυγόνου.
Αυτές είναι μόνο μερικές από τις μεθόδους που μπορούν να χρησιμοποιηθούν για τη διάσπαση του νερού. Ανάλογα με τη συγκεκριμένη εφαρμογή, μια μέθοδος μπορεί να είναι πιο κατάλληλη από την άλλη.