Ομοιοπολικές ενώσεις – Παραδείγματα και ιδιότητες
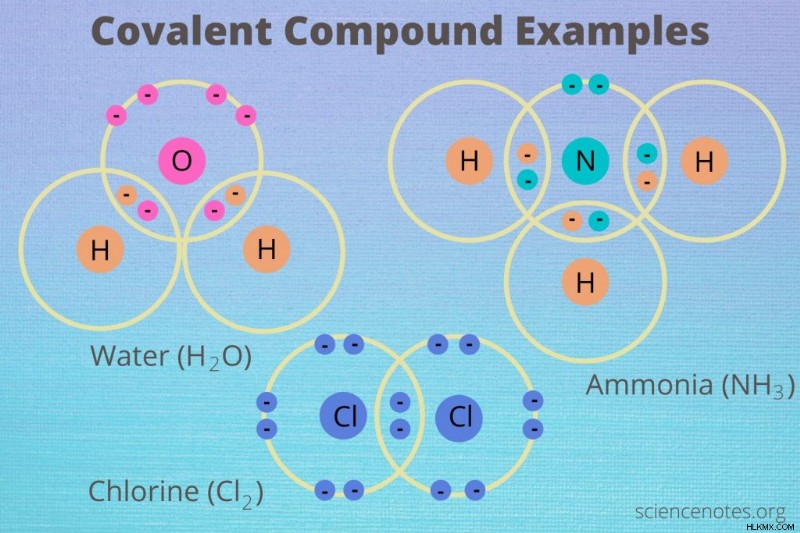
Οι ομοιοπολικές ενώσεις ή οι μοριακές ενώσεις είναι χημικές ενώσεις που αποτελούνται από στοιχεία που συνδέονται με ομοιοπολικούς δεσμούς. Ομοιοπολικοί δεσμοί σχηματίζονται μόνο μεταξύ μη μεταλλικών στοιχείων επειδή αυτά τα στοιχεία έχουν τις ίδιες ή παρόμοιες τιμές ηλεκτραρνητικότητας. Ακολουθούν παραδείγματα ομοιοπολικών ενώσεων και μια ματιά στις κοινές τους ιδιότητες.
Παραδείγματα ομοιοπολικών ενώσεων
Μπορείτε να αναγνωρίσετε ομοιοπολικές ενώσεις επειδή αποτελούνται μόνο από αμέταλλα. Εναλλακτικά, συμβουλευτείτε έναν πίνακα τιμών ηλεκτραρνητικότητας. Εάν οι τιμές ηλεκτραρνητικότητας των στοιχείων σε μια ένωση είναι ίδιες ή παρόμοιες, τότε σχηματίζουν ομοιοπολικές ενώσεις. Κατά γενικό κανόνα, εάν η διαφορά ηλεκτραρνητικότητας είναι μικρότερη από 2 στην κλίμακα Pauling, τα άτομα σχηματίζουν ομοιοπολικούς δεσμούς. Εάν η διαφορά ηλεκτραρνητικότητας είναι 2 ή μεγαλύτερη, τα στοιχεία σχηματίζουν ιοντικούς δεσμούς.
Παραδείγματα ομοιοπολικών ενώσεων περιλαμβάνουν:
- O2 – οξυγόνο
- Cl2 – χλώριο
- PCl3 – τριχλωριούχος φώσφορος
- CH3 CH2 OH – αιθανόλη
- O3 – όζον
- H2 – υδρογόνο
- H2 O – νερό
- HCl – υδροχλώριο
- CH4 – μεθάνιο
- NH3 – αμμωνία
- CO2 – διοξείδιο του άνθρακα
- Πρωτεΐνες
- Υδατάνθρακες (σάκχαρα και άμυλο)
- Λιπίδια (λίπη)
- Νουκλεϊκά οξέα (DNA και RNA)
Σημειώστε ότι οι οργανικές ενώσεις είναι όλες ομοιοπολικές ενώσεις.
Η εξαίρεση στον κανόνα
Γενικά, εάν ένα μόριο αποτελείται εξ ολοκλήρου από αμέταλλα, μπορείτε να υποθέσετε ότι είναι μια ομοιοπολική ένωση. Ωστόσο, υπάρχει μια αξιοσημείωτη εξαίρεση. Το κατιόν αμμωνίου (NH4 ) είναι τόσο ηλεκτροθετικό που σχηματίζει ιοντικούς δεσμούς με αμέταλλα και όχι ομοιοπολικούς δεσμούς. Ταυτόχρονα, οι δεσμοί μεταξύ των ατόμων αζώτου και υδρογόνου είναι ομοιοπολικοί. Έτσι, ενώσεις όπως το χλωριούχο αμμώνιο (NH4 Cl) και νιτρικό αμμώνιο (NH4 ΟΧΙ3 ) περιέχουν τόσο ιοντικούς όσο και ομοιοπολικούς δεσμούς.
Ιδιότητες ομοιοπολικής ένωσης
Οι ομοιοπολικές ενώσεις έχουν μερικές κοινές ιδιότητες:
- Χαμηλά σημεία τήξης
- Χαμηλά σημεία βρασμού
- Κακοί ηλεκτρικοί αγωγοί
- Κακοί θερμικοί αγωγοί
- Σχηματίστε εύθραυστα ή μαλακά στερεά
- Χαμηλές ενθαλπίες σύντηξης
- Χαμηλές ενθαλπίες εξάτμισης
Λόγω των χαμηλών σημείων τήξης τους, πολλές μοριακές ενώσεις είναι υγρά και αέρια σε θερμοκρασία δωματίου. Οι στερεές ομοιοπολικές ενώσεις τείνουν να είναι μαλακές ή εύθραυστες επειδή οι ομοιοπολικοί δεσμοί (και μερικές φορές οι δεσμοί υδρογόνου) είναι σχετικά εύκολο να σπάσουν. Τα κοινά ηλεκτρόνια εντός των ενώσεων περιορίζουν την κινητικότητα των ηλεκτρονίων, επομένως οι ομοιοπολικές ενώσεις δεν μεταδίδουν θερμότητα ή ηλεκτρισμό καθώς και ιοντικές ενώσεις.
Εξασκηθείτε στον εντοπισμό ιοντικών και ομοιοπολικών ενώσεων

Ελέγξτε πόσο καλά κατανοείτε τις ομοιοπολικές ενώσεις χρησιμοποιώντας ένα φύλλο εργασίας. Κατεβάστε και εκτυπώστε αυτό το φύλλο εργασίας PDF και το κλειδί απάντησης που ρωτά τα ονόματα των ενώσεων και εάν είναι ιοντικές ή ομοιοπολικές.
[Φύλλο εργασίας PDF ] [Κλειδί απάντησης ]
Αναφορές
- Campbell, Neil A.; Williamson, Brad; Heyden, Robin J. (2006). Βιολογία:Εξερευνώντας τη ζωή . Βοστώνη, MA:Pearson Prentice Hall. ISBN 0-13-250882-6.
- Μάρτιος, Τζέρι (1992). Προηγμένη Οργανική Χημεία:Αντιδράσεις, Μηχανισμοί και Δομή . John Wiley &Sons. ISBN 0-471-60180-2.
- Stranks, D. R.; Heffernan, Μ. L.; Lee Dow, K. C.; McTigue, Ρ. Τ.; Withers, G. R. A. (1970). Χημεία:Μια δομική άποψη . Carlton, Vic.:Melbourne University Press. ISBN 0-522-83988-6.




