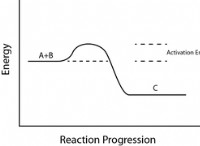
Περιορισμοί των ορισμών και βάσεων Arrhenius;
Εφαρμογή σε υδατικά λύσεις:
Η θεωρία Arrhenius ισχύει αυστηρά μόνο σε υδατικά διαλύματα όπου το νερό χρησιμεύει ως διαλύτης. Δεν αντιπροσωπεύει αντιδράσεις οξέος σε μη υδατικούς διαλύτες, οι οποίοι μπορεί να περιλαμβάνουν διαφορετικούς μηχανισμούς και είδη.
Ατελής ορισμός των βάσεων:
Η θεωρία Arrhenius ορίζει τις βάσεις ως ουσίες που παράγουν ιόντα υδροξειδίου (OH-) όταν διαλύονται σε νερό. Ωστόσο, υπάρχουν πολυάριθμες βασικές ουσίες που δεν περιέχουν ιόντα υδροξειδίου, όπως η αμμωνία (NH3) και το διττανθρακικό νάτριο (NAHCO3).
Ατελής διάσταση:
Όχι όλα τα οξέα και οι βάσεις διαχωρίζονται πλήρως στο νερό για να παράγουν ιόντα. Ορισμένες ενώσεις, όπως αδύναμα οξέα και αδύναμες βάσεις, διαχωρίζονται μόνο εν μέρει, με αποτέλεσμα μερική απελευθέρωση ιόντων Η+ ή ΟΗ. Οι ορισμοί Arrhenius δεν διακρίνουν τα ισχυρά και τα αδύναμα οξέα και τις βάσεις.
αντιδράσεις βάσης οξέος χωρίς μεταφορά πρωτονίων:
Η θεωρία Arrhenius επικεντρώνεται αποκλειστικά στις αντιδράσεις μεταφοράς πρωτονίων που περιλαμβάνουν ιόντα Η+. Ωστόσο, υπάρχουν άλλοι τύποι αντιδράσεων οξέος βάσης που δεν περιλαμβάνουν μεταφορά πρωτονίων. Για παράδειγμα, η αντίδραση των βάσεων Lewis και Lewis περιλαμβάνει την ανταλλαγή ζεύγους ηλεκτρονίων και όχι τη μεταφορά πρωτονίων.
Μη υδατικοί διαλύτες:
Η θεωρία Arrhenius περιορίζεται στην περιγραφή της συμπεριφοράς οξέος-βάσης σε υδατικά διαλύματα. Σε μη υδατικούς διαλύτες, όπως η υγρή αμμωνία ή το συμπυκνωμένο θειικό οξύ, μπορούν να εφαρμοστούν διαφορετικά αποτελέσματα διαλυτοποίησης και μηχανισμοί αντίδρασης, απαιτώντας έναν ευρύτερο ορισμό οξέων και βάσεων πέρα από το πεδίο εφαρμογής της θεωρίας του Arrhenius.
Λόγω αυτών των περιορισμών, αναπτύχθηκαν πιο ολοκληρωμένες θεωρίες, όπως η θεωρία του βρόχου-ληπτικών και η θεωρία του Lewis, για να παρέχουν μια γενικότερη και χωρίς αποκλεισμούς κατανόηση των αντιδράσεων οξέος σε διάφορα χημικά συστήματα.