Τι εννοείται με τη σειρά μετάλλων Reactivty;
Όσο πιο δραστικό είναι ένα μέταλλο, τόσο πιο εύκολα χάνει ηλεκτρόνια και όσο υψηλότερη είναι στη σειρά αντιδραστικότητας. Τα λιγότερο δραστικά μέταλλα βρίσκονται στο κάτω μέρος της σειράς αντιδραστικότητας και είναι πιο δύσκολο να οξειδωθούν.
Η σειρά αντιδραστικότητας των μετάλλων είναι σημαντική επειδή μπορεί να χρησιμοποιηθεί για την πρόβλεψη της αντιδραστικότητας των μετάλλων σε διαφορετικές καταστάσεις. Για παράδειγμα, ένα πιο δραστικό μέταλλο θα αντιδράσει πιο γρήγορα με το οξυγόνο για να σχηματίσει ένα στρώμα οξειδίου, ενώ ένα λιγότερο αντιδραστικό μέταλλο θα αντιδράσει πιο αργά.
Ακολουθεί μια λίστα με τα πιο κοινά μέταλλα στη σειρά αντιδραστικότητας, από το πιο αντιδραστικό έως το λιγότερο αντιδραστικό:
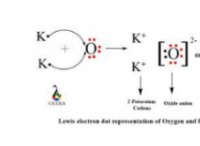
* Κάλιο (k)
* Νάτριο (Na)
* Ασβέστιο (CA)
* Μαγνήσιο (mg)
* Αλουμίνιο (AL)
* Ψευδάργυρος (Zn)
* Σίδερο (Fe)
* Νικέλιο (NI)
* Κασσίτερος (SN)
* Μόλυβδος (PB)
* Υδρογόνο (Η)
* Χαλκός (Cu)
* Ασημί (AG)
* Χρυσός (AU)
Είναι σημαντικό να σημειωθεί ότι η σειρά αντιδραστικότητας δεν είναι απόλυτη και η αντιδραστικότητα ενός μετάλλου μπορεί να επηρεαστεί από διάφορους παράγοντες, όπως η θερμοκρασία και η παρουσία άλλων ουσιών.