Υβριδισμός διοξειδίου του άνθρακα
Για τον προσδιορισμό του υβριδισμού του διοξειδίου του άνθρακα, ας πάρουμε πρώτα το άτομο του άνθρακα. Το άτομο του άνθρακα περιλαμβάνει 2 διπλούς δεσμούς, δηλαδή υπάρχουν 2 ενεργά ζεύγη σε αυτό. Ωστόσο, αυτό δεν είναι αρκετό για τη δημιουργία δεσμών που περιλαμβάνουν το οξυγόνο. Επομένως, ένα ηλεκτρόνιο από το τροχιακό 2s μετατοπίζεται από το επίπεδο 2s στο επίπεδο 2p, γεγονός που οδηγεί στη δημιουργία 2 υβριδικών τροχιακών. Αυτά τα υβριδισμένα τροχιακά sp που ανήκουν στα άτομα άνθρακα εκτείνονται πέρα από τα τροχιακά 2p που ανήκουν στα άτομα του οξυγόνου για τη δημιουργία δεσμών δύο σίγμα. Ένας δεσμός pi σχηματίζεται μεταξύ των 2 ηλεκτρονίων p που έχουν απομείνει.
Το οξυγόνο υβριδοποίησε το τροχιακό του για να δημιουργήσει 3 υβριδικά τροχιακά sp2 στο μόριο CO2. Επιπλέον, το τροχιακό p μέσα στο άτομο του οξυγόνου παραμένει το ίδιο και χρησιμοποιείται κυρίως για τη δημιουργία ενός δεσμού pi. Ωστόσο, μόνο 1 sp υβριδικό τροχιακό θα χρησιμοποιηθεί από αυτά τα 3 sp υβριδικά τροχιακά για τη δημιουργία δεσμού με άτομα άνθρακα.
Υπολογισμός υβριδισμών
Αρχικά, ας μάθουμε τους τύπους δεσμών στο μόριο κάνοντας τη χημική δομή του μορίου. Ειδικότερα, σημειώστε τον αριθμό των απλών, διπλών και τριπλών δεσμών που δημιουργούνται από κάθε άτομο. Για παράδειγμα, το μόριο O του CO2 περιλαμβάνει 2 διπλούς δεσμούς. Το μόριο μπορεί να αναπαρασταθεί με τη μορφή:O =C =O, όπου κάθε άτομο οξυγόνου δημιουργεί διπλό δεσμό με τον κεντρικό άνθρακα.
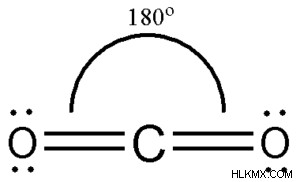
Ο υβριδισμός ορίζεται με τα τροχιακά sp. Τα αλφάβητα "s" καθώς και "p" βοηθούν στον προσδιορισμό του σχήματος των τροχιακών μονοπατιών στις οποίες ταξιδεύει το ηλεκτρόνιο. Στην περίπτωση των τροχιακών «s», η διαδρομή έχει περίπου κυκλικό σχήμα. Στην περίπτωση των τροχιακών "p", το σχήμα της διαδρομής μοιάζει με αλτήρα και περιλαμβάνει το ηλεκτρόνιο που υπάρχει κυρίως σε 1 από 2 περιοχές και όχι σε κυκλική τροχιά.
Στη συνέχεια, προσδιορίστε τον υβριδισμό κάθε ατόμου με τη βοήθεια των τύπων των υπαρχόντων δεσμών. Η απουσία των διπλών δεσμών αντιπροσωπεύει έναν υβριδισμό του sp3. Ένα άτομο που έχει έναν απλό δεσμό περιλαμβάνει υβριδισμό του sp2. Ένα άτομο με 2 ή περισσότερους από 2 διπλούς δεσμούς ή με απλό τριπλό δεσμό, περιλαμβάνει υβριδισμό του sp.
Το άτομο του άνθρακα στο CO2 έχει 2 διπλούς δεσμούς, ένας από τους οποίους έχει κάθε άτομο οξυγόνου. Έτσι, ο υβριδισμός του άνθρακα είναι sp. Κάθε άτομο οξυγόνου στο CO2 έρχεται με έναν απλό διπλό δεσμό με τον άνθρακα. Επιπλέον, ο υβριδισμός κάθε υδρογόνου είναι στη συνέχεια sp2. Ο συνολικός υβριδισμός του μορίου πρέπει να προσδιοριστεί με την εύρεση του υβριδισμού του κεντρικού ατόμου. Στο CO2, ο άνθρακας είναι το άτομο στο κέντρο. Αυτό συμβαίνει επειδή ο άνθρακας έχει sp υβριδισμό. Επομένως, ο συνολικός υβριδισμός του μορίου είναι sp.
Ιδιότητες CO2
Το CO2 έχει υβριδισμό τύπου sp. Αυτός ο τύπος υβριδισμού λαμβάνει χώρα ως αποτέλεσμα της δέσμευσης του άνθρακα με δύο άλλα άτομα. Οι δεσμοί μπορεί να είναι 1 απλοί + 1 τριπλοί ή 2 διπλοί δεσμοί. Μπορεί επίσης να βρεθεί στενά με την παρατήρηση κάθε ατόμου CO2.
Υβριδισμός άνθρακα σε CO2
Η ηλεκτρονιακή διαμόρφωση του άνθρακα είναι 1s2 2s2 2p2 στη θεμελιώδη κατάσταση. Ένα από τα ηλεκτρόνια από τα ηλεκτρόνια 2s μπορεί να θεωρηθεί ότι θέλει να γεμίσει το άλλο απλήρωτο τροχιακό 2p για να δώσει μια διαμόρφωση 1s2 2s1 2p3. Κάθε μεμονωμένο τροχιακό 2p, 2px, 2pz, 2py, στη συνέχεια κρατά ένα μόνο ηλεκτρόνιο. Τα τροχιακά 2s, καθώς και ένα από τα τροχιακά 2p, υποθέτουν ότι το 2py μπορεί ενδεχομένως να υβριδοποιήσει και να δημιουργήσει υβριδικά τροχιακά 2 sp. Το οξυγόνο έχει 1s2 2s2 2p4 διαμόρφωση ηλεκτρονίων που ανήκουν στη θεμελιώδη κατάσταση.
Δύο τροχιακά 2p, όπως το 2px καθώς και το 2pz, συγκρατούν μόνο ένα ηλεκτρόνιο. Επιπλέον, το 2px μπορεί τώρα να επεκταθεί πέρα από ένα από αυτά τα υβρίδια sp από τον άνθρακα για τη δημιουργία ενός προκύπτοντος δεσμού «σ». Το 2pz μπορεί τώρα πιθανώς να επεκταθεί πέρα από το μη υβριδοποιημένο 2-pz στον άνθρακα για να οδηγήσει σε έναν δεσμό π. Μια πανομοιότυπη διαδικασία μπορεί να συμβεί στις διαφορετικές πλευρές του άνθρακα, δημιουργώντας έναν άλλο δεσμό «π» με τα τροχιακά 2-py από κάθε άτομο καθώς και τον δεσμό «σ» με 2 pz του οξυγόνου.
Συμπέρασμα
Ο υβριδισμός του διοξειδίου του άνθρακα καταλήγει στο πώς μπορείτε να ανακαλύψετε τον υβριδισμό του CO2. Λέει διάφορα αποτελέσματα και αποτελέσματα πολλαπλών αντιδράσεων που προσθέτουν στον υβριδισμό του διοξειδίου του άνθρακα. Επιπλέον, η διαδικασία υπολογισμού του υβριδισμού ορίζεται επίσης σε αυτήν την υβριδοποίηση σημειώσεων διοξειδίου του άνθρακα για καλύτερη κατανόηση του θέματος. Επιπλέον, οι ιδιότητες του CO2 συζητούνται σε αυτό το άρθρο.




