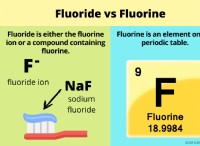
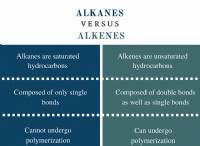
Ποια είναι τα ηλεκτρόνια του εσωτερικού κελύφους;
Τα εσωτερικά κελύφη επισημαίνονται ανάλογα με την εγγύτητά τους με τον πυρήνα, με το εσωτερικό κέλυφος να ορίζεται ως το κέλυφος Κ, ακολουθούμενο από L, M, N και ούτω καθεξής. Κάθε κέλυφος μπορεί να κρατήσει έναν συγκεκριμένο αριθμό ηλεκτρονίων, με βάση τις αρχές της κβαντικής μηχανικής.
* k Shell: Αυτό είναι το εσωτερικό κέλυφος και μπορεί να συγκρατήσει έως και 2 ηλεκτρόνια.
* l Shell: Το κέλυφος L είναι το δεύτερο επίπεδο ενέργειας και μπορεί να φιλοξενήσει έως και 8 ηλεκτρόνια (2s και 2p subshells).
* M Shell: Το κέλυφος M είναι το τρίτο επίπεδο ενέργειας και μπορεί να συγκρατήσει έως και 18 ηλεκτρόνια (3s, 3p και 3d subshells).
* n Shell: Το N Shell είναι το τέταρτο επίπεδο ενέργειας και μπορεί να φιλοξενήσει έως και 32 ηλεκτρόνια (4s, 4p, 4d και 4f subshells).
Τα ηλεκτρόνια του εσωτερικού κελύφους είναι γενικά πιο στενά συνδεδεμένα με τον πυρήνα από τα ηλεκτρόνια του εξωτερικού κελύφους. Αυτό οφείλεται στο γεγονός ότι βιώνουν μια ισχυρότερη ηλεκτροστατική δύναμη έλξης από τον πυρήνα λόγω του υψηλότερου θετικού του φορτίου. Όσο πιο κοντά ένα ηλεκτρόνιο είναι στον πυρήνα, τόσο χαμηλότερη είναι η ενέργεια του και όσο πιο έντονα κρατιέται.
Η διάταξη και η συμπεριφορά των ηλεκτρόνων του εσωτερικού κελύφους διαδραματίζουν καθοριστικό ρόλο σε διάφορες ατομικές ιδιότητες και διαδικασίες. Συμβάλλουν στη συνολική διαμόρφωση ηλεκτρονίων ενός στοιχείου και επηρεάζουν τη χημική συμπεριφορά σύνδεσης, το ατομικό μέγεθος, την ενέργεια ιονισμού και άλλες θεμελιώδεις ιδιότητες.