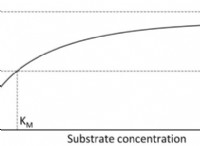
Πώς υπολογίζετε την ενέργεια ενεργοποίησης στην κατάλυση;
1. Εξίσωση Arrhenius:
Αυτή είναι η πιο συνηθισμένη μέθοδος και περιλαμβάνει τη μελέτη των ρυθμών αντίδρασης σε διαφορετικές θερμοκρασίες. Η εξίσωση Arrhenius είναι:
k =a * exp (-ea/rt)
Οπου:
* k είναι η σταθερά ρυθμού της αντίδρασης
* A είναι ο προ-εκθετικός παράγοντας (συντελεστής συχνότητας)
* ea είναι η ενέργεια ενεργοποίησης
* r είναι η ιδανική σταθερά αερίου (8.314 j/mol · k)
* t είναι η απόλυτη θερμοκρασία στο Kelvin
Για να υπολογίσετε την ΕΑ χρησιμοποιώντας την εξίσωση Arrhenius, πρέπει να:
* Μετρήστε τη σταθερά ρυθμού (k) σε δύο ή περισσότερες διαφορετικές θερμοκρασίες.
* Plot ln (k) έναντι 1/t. Αυτό θα σας δώσει μια ευθεία γραμμή με μια κλίση -ea/r.
* Υπολογίστε την κλίση της γραμμής και πολλαπλασιάστε την με -R για να αποκτήσετε ea.
2. Εξίσωση Eyring (θεωρία κατάστασης μετάβασης):
Αυτή η μέθοδος είναι πιο πολύπλοκη, αλλά μπορεί να προσφέρει μια πιο ακριβή τιμή για την ΕΑ. Σχετίζεται με τη σταθερά ρυθμού με την ελεύθερη ενέργεια Gibbs (ΔG ‡):
k =(k_b * t/h) * exp (-Δg ‡/rt)
Οπου:
* k_b είναι το Boltzmann Constant
* h είναι η σταθερά Planck
* ΔG ‡ Είναι η ελεύθερη ενέργεια Gibbs
Για τον υπολογισμό της ΕΑ χρησιμοποιώντας την εξίσωση Eyring:
* Προσδιορίστε την ελεύθερη ενέργεια Gibbs (ΔG ‡) χρησιμοποιώντας πειραματικά δεδομένα.
* Χρησιμοποιήστε την εξίσωση ΔG ‡ =ΔH ‡ - TΔS ‡ Για να υπολογίσετε την ενθαλπία της ενεργοποίησης (ΔH ‡)
* ea =ΔH ‡ + rt.
3. Υπολογιστικές μέθοδοι:
Οι προηγμένες μεθόδους υπολογιστικής χημείας μπορούν να χρησιμοποιηθούν για τον υπολογισμό της ενέργειας ενεργοποίησης, ειδικά για σύνθετες αντιδράσεις. Αυτές οι μέθοδοι περιλαμβάνουν:
* Κβαντικοί μηχανικοί υπολογισμοί: Αυτές οι μέθοδοι παρέχουν εξαιρετικά ακριβείς τιμές για την ΕΑ.
* Προσομοιώσεις μοριακής δυναμικής: Αυτές οι μέθοδοι προσομοιώνουν την κίνηση των ατόμων και των μορίων, επιτρέποντάς σας να λάβετε πληροφορίες σχετικά με την οδό αντίδρασης και την ενέργεια ενεργοποίησης.
Βασικά σημεία που πρέπει να θυμάστε:
* Οι καταλύτες μειώνουν την ενέργεια ενεργοποίησης μιας αντίδρασης, αλλά δεν αλλάζουν τη σταθερά ισορροπίας. Αυτό σημαίνει ότι επιταχύνουν τον ρυθμό αντίδρασης, αλλά δεν επηρεάζουν τις τελικές ποσότητες αντιδραστηρίων και προϊόντων σε ισορροπία.
* Οι τιμές ενέργειας ενεργοποίησης εκφράζονται συνήθως σε μονάδες joules ανά mole (j/mol) ή kilojoules ανά mole (kJ/mol).
Επιλέγοντας τη σωστή μέθοδο:
Η επιλογή της μεθόδου εξαρτάται από τα διαθέσιμα πειραματικά δεδομένα, την πολυπλοκότητα της αντίδρασης και το επιθυμητό επίπεδο ακρίβειας. Η εξίσωση Arrhenius είναι κατάλληλη για απλές αντιδράσεις με άμεσα διαθέσιμα δεδομένα σταθερής ταχύτητας. Η εξίσωση Eyring είναι ακριβέστερη, αλλά απαιτεί πρόσθετες πληροφορίες σχετικά με την κατάσταση μετάβασης. Οι υπολογιστικές μέθοδοι προσφέρουν υψηλή ακρίβεια, αλλά απαιτούν εξειδικευμένο λογισμικό και εμπειρογνωμοσύνη.