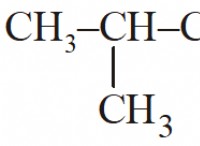Ποια επίσημη φόρτιση έχει ο άνθρακας;
Εδώ είναι γιατί:
* ηλεκτρόνια σθένους: Ο άνθρακας έχει 4 ηλεκτρόνια σθένους.
* δεσμοί: Ο άνθρακας συνήθως σχηματίζει 4 ομοιοπολικούς δεσμούς, μοιράζοντας ένα ηλεκτρόνιο με κάθε άτομο που συνδέεται με.
* Τυπικός υπολογισμός φόρτισης: Η επίσημη χρέωση υπολογίζεται ως:
* Τυπική φόρτιση =(ηλεκτρόνια σθένους) - (ηλεκτρόνια μη σύνδεσης) - (1/2 * ηλεκτρόνια συγκόλλησης)
* Στην περίπτωση του άνθρακα, αυτό θα ήταν 4 - 0 - (1/2 * 8) =0
Ωστόσο, ο άνθρακας μπορεί να έχει επίσημη φόρτιση σε ορισμένες καταστάσεις, όπως:
* Carbocations: Αυτά έχουν θετικό επίσημο φορτίο για τον άνθρακα λόγω της απώλειας ενός ηλεκτρονίου.
* Carbanions: Αυτά έχουν αρνητικό επίσημο φορτίο για τον άνθρακα λόγω του κέρδους ενός ηλεκτρονίου.
Είναι σημαντικό να σημειωθεί ότι η επίσημη φόρτιση είναι απλώς μια θεωρητική τιμή και η πραγματική κατανομή φορτίου σε ένα μόριο είναι πιο περίπλοκη.