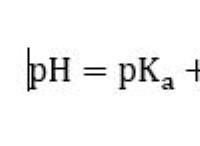Δομή και συγκόλληση υδρογόνου;
Δομή και σύνδεση υδρογόνου (H₂S)
Δομή:
* Μοριακό σχήμα: Λυγισμένο ή σχήμα V.
* Γωνία δεσμού: Περίπου 92 °.
* υβριδοποίηση: sp
* πολικότητα: Πολικό μόριο.
δεσμός:
* Τύπος δεσμών: Δύο ομοιοπολικοί δεσμοί μεταξύ του θείου και κάθε ατόμου υδρογόνου.
* Ηλεκτροργατιστικότητα: Το θείο (2,58) είναι πιο ηλεκτροαρνητικό από το υδρογόνο (2.20).
* πολικοί ομοιοπολικοί δεσμοί: Λόγω της διαφοράς στην ηλεκτροαρνητικότητα, το ζεύγος ηλεκτρονίων σε κάθε δεσμό S-H μετατοπίζεται ελαφρώς προς το άτομο θείου, δημιουργώντας ένα μερικό αρνητικό φορτίο στο θείο και ένα μερικό θετικό φορτίο σε κάθε άτομο υδρογόνου. Αυτό έχει ως αποτέλεσμα έναν πολικό ομοιοπολικό δεσμό.
* Ζεύγη: Το Sulphur έχει δύο μοναχικά ζεύγη ηλεκτρονίων που είναι υπεύθυνα για το λυγισμένο σχήμα του μορίου και συμβάλλουν στην πολικότητα του.
Διάγραμμα:
`` `
H
|
μικρό
/ \
H h
`` `
Ιδιότητες:
* οσμή: Σάπια μυρωδιά αυγών.
* Άχρωμο αέριο σε θερμοκρασία δωματίου.
* τοξικά και εύφλεκτα.
* Διαλυτότητα: Ελαφρώς διαλυτή στο νερό.
Βασικά σημεία:
* Το λυγισμένο σχήμα του H₂s οφείλεται στην παρουσία μόνων ζευγών στο άτομο θείου, τα οποία απωθούν τα ζεύγη ηλεκτρονίων συγκόλλησης.
* Η πολικότητα του H₂S οφείλεται στην άνιση κοινή χρήση ηλεκτρονίων στους δεσμούς S-H, γεγονός που δημιουργεί μια διπολική στιγμή.
* Οι ιδιότητες του H₂s επηρεάζονται από τη δομή και τη συγκόλλησή του. Για παράδειγμα, η έντονη οσμή του οφείλεται στην ικανότητά της να αλληλεπιδρά με οσφρητικούς υποδοχείς στη μύτη.
Συνοπτικά, το H₂S έχει ένα λυγισμένο σχήμα, πολικούς ομοιοπολικούς δεσμούς και δύο μοναχικά ζεύγη στο άτομο θείου. Οι ιδιότητες δομής και συγκόλλησης είναι υπεύθυνες για τις χαρακτηριστικές του ιδιότητες, συμπεριλαμβανομένης της έντονης οσμής, της τοξικότητας και της ευελιξιμότητας.