Εξίσωση Henderson-Hasselbalch
Βασικές έννοιες
Σε αυτό το σεμινάριο, θα μάθετε τι είναι η εξίσωση Henderson-Hasselbalch, πώς να χρησιμοποιήσετε την εξίσωση για τον προσδιορισμό του pH ενός ρυθμιστικού διαλύματος, πώς να εξαγάγετε την εξίσωση και πώς να λύσετε μερικά παραδείγματα προβλημάτων
Τι είναι η εξίσωση Henderson Hasselbalch;
Η εξίσωση Henderson-Hasselbalch χρησιμοποιείται για τον προσδιορισμό του pH ενός ρυθμιστικού συστήματος.

Το Ka είναι η σταθερά διάστασης οξέος και το pKa είναι το αρνητικό log του Ka . Η [Συζευγμένη Βάση] γράφεται επίσης συνήθως ως [Α-]. Και το [Ασθενές οξύ] μπορεί να θεωρηθεί ως [HA]. Αυτές οι τιμές αναφέρονται στη συγκέντρωση ισορροπίας.
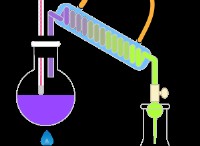
Εάν έχετε την ίδια συγκέντρωση οξέος και συζυγούς βάσης, τότε το pH θα είναι ίδιο με το pKa επειδή το log(1) =0.
Αν [HA] =[A], τότε
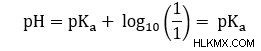
Παραγωγή της εξίσωσης Henderson-Hasselbalch
Η εξίσωση Henderson-Hasselbalch μπορεί να προέλθει από το Ka ενός ασθενούς οξέος. Εδώ θα υποθέσουμε ότι έχουμε ένα ασθενές οξύ, HA, και τη συζυγή του βάση, Α. Στο νερό συμβαίνει η ακόλουθη διάσταση:
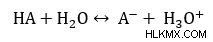
Επομένως, η σταθερά διάστασης οξέος ορίζεται ως
Το οποίο μπορεί να αναδιαταχθεί σε
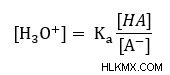
Στη συνέχεια, πάρτε το κούτσουρο και των δύο πλευρών
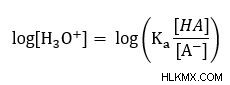
Πολλαπλασιάστε με -1 ώστε στο επόμενο βήμα να υποκαταστήσουμε το pH.
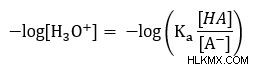
Με βάση τον ορισμό του pH =-log [H3 O] μπορούμε να αντικαταστήσουμε στην εξίσωσή μας
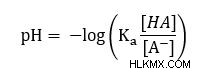
Στη συνέχεια χρησιμοποιήστε κανόνες λογάριθμου για να απλοποιήσετε τη δεξιά πλευρά
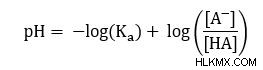
Γνωρίζοντας ότι pKa =-log(Ka ), μπορούμε να το αντικαταστήσουμε στην προηγούμενη εξίσωσή μας για να φτάσουμε στην εξίσωση Henderson-Hasselbalch
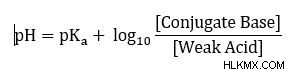
Παράδειγμα προβλημάτων της εξίσωσης Henderson Hasselbalch
Προσδιορισμός αναλογίας buffer
Ας υποθέσουμε ότι φτιάχνουμε ένα ρυθμιστικό διάλυμα αμμωνίου (NH4 ) και αμμωνία (NH3 ). Σε αυτό το παράδειγμα, το αμμώνιο είναι το ασθενές μας οξύ και η αμμωνία είναι η συζευγμένη βάση. Η αντίδραση είναι η εξής.
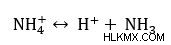
Αν το pKa του αμμωνίου είναι 9,3 και θέλουμε pH 10. Ποια αναλογία αμμωνίας προς αμμώνιο πρέπει να προστεθεί στο διάλυμα;
Το πρόβλημα ζητά μια αναλογία, επομένως αναζητούμε την τιμή του 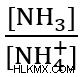 ή
ή 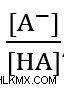 για τη συγκεκριμένη λύση buffer. Για να λύσετε το πρόβλημα, ξεκινήστε συνδέοντας τις γνωστές τιμές – pH και pKa .
για τη συγκεκριμένη λύση buffer. Για να λύσετε το πρόβλημα, ξεκινήστε συνδέοντας τις γνωστές τιμές – pH και pKa .
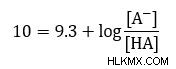
Αφαιρέστε 9,3 από κάθε πλευρά για απλοποίηση
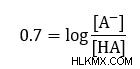
Ο λόγος που αναζητούμε είναι εντός του λογαριθμικού όρου. Για να απαλλαγούμε από το αρχείο καταγραφής, μπορούμε να χρησιμοποιήσουμε λογαριθμικούς κανόνες για απλοποίηση.
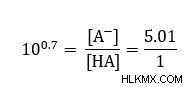
Επομένως, η αναλογία είναι περίπου 5 φορές η ποσότητα αμμωνίας από το αμμώνιο για να ληφθεί ένα ρυθμιστικό διάλυμα με pH 10.
Προσδιορισμός του pH
Χρησιμοποιήστε την εξίσωση Henderson-Hasselbalch για να προσδιορίσετε το pH ενός ρυθμιστικού διαλύματος που αποτελείται από 0,15 M CH3 COO και 0,20 M CH3 COOH. Το pKa του οξικού οξέος (CH3 COOH) είναι 4,75.
Για να λύσουμε αυτό το παράδειγμα προβλήματος, θέλουμε να ξεκινήσουμε με την εξίσωση Henderson-Hasselbalch, καθώς εξετάζουμε μια ρυθμιστική λύση ασθενούς οξέος και συζυγούς βάσης.
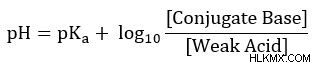
Στη συνέχεια, συνδέστε τις γνωστές τιμές στην εξίσωσή μας
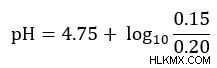
Στη συνέχεια απλοποιήστε και λύστε
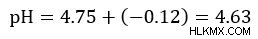
Το ρυθμιστικό μας διάλυμα οξικού οξέος έχει pH 4,63.
Περιορισμοί της εξίσωσης Henderson-Hasselbalch
- Όταν χρησιμοποιείτε το Henderson-Hasselbalch για να φτιάξετε ένα ρυθμιστικό διάλυμα, η αναλογία [A]/[HA] πρέπει να είναι κοντά στο ένα. Αυτό κάνει την πιο σταθερή λύση. Όταν η αναλογία απομακρύνεται πολύ από τη μία, η ικανότητα να ρυθμίζεται το διάλυμα μειώνεται καθώς μια μικρή διαταραχή αλλάζει δραματικά το pH.
- Αυτή η εξίσωση pH δεν λαμβάνει υπόψη την αυτοδιάσπαση του νερού. Σε πολύ χαμηλές συγκεντρώσεις ρυθμιστικού διαλύματος, το νερό μπορεί να συμβάλει στο pH
- Εάν ένα οξύ μπορεί εύκολα να διαχωρίσει περισσότερα από ένα ιόντα υδρονίου (Η), η εξίσωση δεν το λαμβάνει υπόψη και μπορεί να μην λειτουργεί καλά.
- Πρακτικά όταν φτιάχνετε συγκεκριμένα ρυθμιστικά διαλύματα pH, είναι σημαντικό να έχετε το pKa να είναι κοντά στο pH στόχο για να έχετε το μεγαλύτερο εύρος ρυθμιστικής ικανότητας.
Διασκεδαστικά γεγονότα:
- Η εξίσωση πήρε το όνομά της από τους Lawrence Joseph Henderson και Karl Albert Hasselbalch. Ο Χέντερσον έκανε την αρχική εξίσωση το 1908. Στη συνέχεια, το 1917 ο Χάσελμπαλχ έβαλε τον τύπο σε λογαριθμικούς όρους και τον τρόπο που τον βλέπουμε περισσότερο σήμερα.
- Η εξίσωση Henderson-Hasselbalch έχει σημαντική βιολογική συνάφεια. Πολλά βιολογικά δείγματα πρέπει να διατηρούνται σε συγκεκριμένο pH. Έτσι, όταν προετοιμάζονται τα δείγματα, η εξίσωση Henderson-Hasselbalch χρησιμοποιείται για την παρασκευή ενός ρυθμιστικού διαλύματος που θα βοηθήσει τις πρωτεΐνες και άλλα ευαίσθητα στο pH μόρια να διατηρήσουν τη δομή τους.
- Η εξίσωση μπορεί επίσης να γραφτεί για το pOH ενός ρυθμιστικού συστήματος.
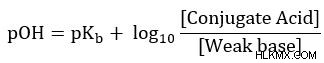
Το [Συζευγμένο οξύ] αναφέρεται επίσης ως [HB]. Και η [Αδύναμη Βάση] αναφέρεται επίσης ως [B]. Δοκιμάστε να ελέγξετε την κατανόησή σας περνώντας από την παραγωγή για την έκδοση pOH της εξίσωσης.