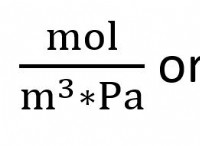Πόσες γραμμομορείς του H2O παράγονται όταν καίγεται 0,468 mol οκτανίου;
1. Γράψτε την ισορροπημένη χημική εξίσωση για την καύση του οκτανίου:
C₈h₁₈ + 25/2 o₂ → 8 co₂ + 9 h₂o
2. Προσδιορίστε την αναλογία mole μεταξύ οκτανίου και νερού:
Από την ισορροπημένη εξίσωση, βλέπουμε ότι 1 mole του οκτανίου (C₈H₁₈) παράγει 9 γραμμομονείς νερού (H₂O).
3. Υπολογίστε τις γραμμομορείς του νερού που παράγεται:
* Χρησιμοποιήστε τον λόγο mole για να μετατρέψετε τις γραμμομορείς οκτανίου σε γραμμομορείς νερού:
0.468 mol c₈H₁₈ * (9 mol h₂o / 1 mol c₈H₁₈) = 4.212 mol h₂o
Επομένως, 4.212 moles νερού παράγονται όταν καίγονται 0.468 γραμμομορείς οκτανίου.