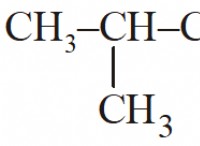Τι είδους αντίδραση εξαρτάται από τα προϊόντα συγκέντρωσης και τα αντιδραστήρια;
Εδώ είναι γιατί:
* Αναστρέψιμες αντιδράσεις Προχωρήστε και στις δύο κατευθύνσεις, δηλαδή τα αντιδραστήρια μπορούν να σχηματίσουν προϊόντα και τα προϊόντα μπορούν επίσης να αντιδράσουν για να σχηματίσουν αντιδραστήρια.
* Ο ρυθμός κάθε κατεύθυνσης (προς τα εμπρός και αντίστροφα) επηρεάζεται από τις συγκεντρώσεις των εμπλεκόμενων ειδών.
* ισορροπία επιτυγχάνεται όταν οι ρυθμοί των εμπρόσθιων και αντίστροφων αντιδράσεων γίνονται ίσοι, πράγμα που σημαίνει ότι η καθαρή μεταβολή της συγκέντρωσης των αντιδραστηρίων και των προϊόντων είναι μηδενική.
Παραδείγματα αναστρέψιμων αντιδράσεων:
* Η διαδικασία Haber-Bosch: N₂ (g) + 3H₂ (g) ⇌ 2nh₃ (g)
* Η αντίδραση του υδρογόνου και του ιωδίου: H₂ (g) + i₂ (g) ⇌ 2hi (g)
* Η διάλυση ενός αλατιού σε νερό: NaCl ⇌ na⁺ (aq) + cl⁻ (aq)
Αντίθετα, μη αναστρέψιμες αντιδράσεις Προχωρήστε μόνο προς τη μία κατεύθυνση και ο ρυθμός τους δεν επηρεάζεται σημαντικά από τη συγκέντρωση των προϊόντων.