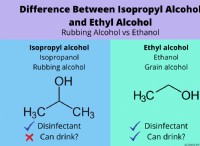
Γιατί οι χημικοί χρησιμοποιούν το ποσοστό κατ 'όγκο για να προετοιμάσουν και να περιγράψουν πολλές λύσεις που χρησιμοποιούν;
* Απλότητα: Είναι απλό να υπολογίσουμε και να κατανοήσουμε. Απλά διαιρέστε τον όγκο της διαλελυμένης ουσίας με τον συνολικό όγκο του διαλύματος και πολλαπλασιάστε κατά 100%.
* άμεσα σχετική: Το ποσοστό κατ 'όγκο σχετίζεται άμεσα με την ποσότητα διαλυμένης ουσίας στον συνολικό όγκο του διαλύματος, καθιστώντας ευκολότερη την απεικόνιση της συγκέντρωσης. Για παράδειγμα, ένα διάλυμα 10% V/V σημαίνει ότι υπάρχει 10 ml διαλυμένης ουσίας σε κάθε 100 mL διαλύματος.
* Βολικό για υγρά: Είναι ιδιαίτερα χρήσιμο για λύσεις όπου τόσο η διαλυμένη ουσία όσο και ο διαλύτης είναι υγρά, καθώς αντικατοπτρίζει άμεσα τον λόγο όγκου μεταξύ των δύο.
* κατάλληλο για αραιώσεις: Είναι σχετικά εύκολο να αραιώνονται διαλύματα που παρασκευάζονται κατ 'όγκο. Απλά χρησιμοποιήστε τον κατάλληλο λόγο όγκου για να επιτύχετε την επιθυμητή συγκέντρωση.
Ωστόσο, υπάρχουν ορισμένοι περιορισμοί στη χρήση ποσοστού ανά όγκο:
* Εξάρτηση θερμοκρασίας: Ο όγκος εξαρτάται από τη θερμοκρασία. Εάν αλλάξει η θερμοκρασία του διαλύματος, ο όγκος τόσο του διαλυμένου και του διαλύτη θα αλλάξει, ενδεχομένως μεταβάλλοντας τη συγκέντρωση.
* Δεν είναι ιδανικό για στερεά ή αέρια: Είναι λιγότερο χρήσιμο για λύσεις όπου η ουσία είναι ένα στερεό ή ένα αέριο. Ο όγκος ενός στερεού ή αερίου μπορεί να ποικίλει σημαντικά με πίεση και θερμοκρασία, καθιστώντας το λιγότερο αξιόπιστο για την ακρίβεια που αντιπροσωπεύει τη συγκέντρωση.
εναλλακτικές λύσεις σε ποσοστό κατ 'όγκο:
* τοις εκατό κατά μάζα (% β/β): Αυτό είναι ακριβέστερο για τα στερεά και τα αέρια, καθώς η μάζα είναι ένα πιο αξιόπιστο μέτρο από τον όγκο.
* Μοριακή (m): Αυτό εκφράζει τη συγκέντρωση ως γραμμομορείς διαλυμένης ουσίας ανά λίτρο διαλύματος, καθιστώντας το ιδανικό για αντιδράσεις και στοιχειομετρία.
Συνολικά, ενώ το ποσοστό κατ 'όγκο έχει τους περιορισμούς του, παραμένει ένα πολύτιμο εργαλείο για τους χημικούς, ιδιαίτερα για την προετοιμασία και την περιγραφή λύσεων όπου τόσο η διαλυμένη ουσία όσο και ο διαλύτης είναι υγρά.