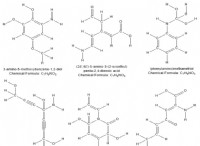
Ποια είναι τα 5 παραδείγματα διαλυτών;
1. νερό (h₂o) :Ο πιο συνηθισμένος διαλύτης, ειδικά για πολικές ουσίες.
2. αιθανόλη (C₂H₅OH) :Ένας κοινός διαλύτης που χρησιμοποιείται σε πολλές βιομηχανικές διεργασίες και σε αλκοολούχα ποτά.
3. ακετόνη (ch₃coch₃) :Ένας ευπροσάρμοστος διαλύτης που χρησιμοποιείται σε αφαίρεση βερνικιών νυχιών, λεπτότερη βαφή και πολλές βιομηχανικές διεργασίες.
4. εξάνιο (c₆h₁₄) :Ένας μη πολικός διαλύτης που χρησιμοποιείται συχνά για την εξαγωγή ελαίων και λιπών.
5. toluene (c₇h₈) :Ένας διαλύτης που συνήθως βρίσκεται σε χρώματα, συγκολλητικές ουσίες και τσιμέντα από καουτσούκ.