Δομές συντονισμού
Βασικές έννοιες
Σε αυτό το σεμινάριο σχετικά με τις δομές συντονισμού , θα μάθετε τι είναι οι δομές συντονισμού και πώς να βρείτε όλες τις πιθανές δομές συντονισμού που έχει ένα μόριο. Θα μάθετε επίσης πώς να αναγνωρίζετε και να συγκρίνετε τη σταθερότητα μεταξύ αυτών των δομών.
Θέματα που καλύπτονται σε άλλα άρθρα
- Ηλεκτραρνητικότητα
- Δομές Lewis Dot
- Επίσημες χρεώσεις
Τι είναι οι δομές συντονισμού;
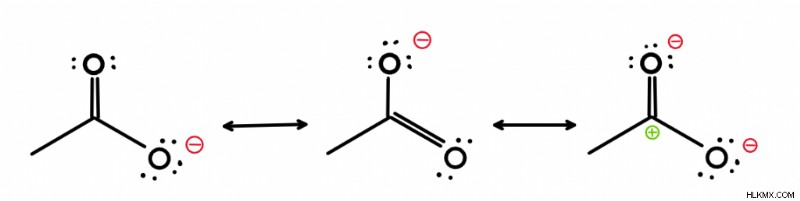
Οι δομές συντονισμού είναι διάφορες μορφές του ίδιου μορίου όπου τα ηλεκτρόνια έχουν μεταφερθεί από τη μια περιοχή στην άλλη.
Γιατί είναι σημαντικές οι δομές συντονισμού;
Οι δομές συντονισμού είναι σημαντικές επειδή παρέχουν μια πολύ πιο ρεαλιστική άποψη του σχήματος ενός μορίου. Θα πρέπει να σημειωθεί ότι κάθε μεμονωμένη δομή συντονισμού υπολογίζεται κατά μέσο όρο σε ένα υβρίδιο συντονισμού που είναι και το αληθινό σχήμα του μορίου και η πιο σταθερή μορφή συντονισμού.
Πώς βρίσκετε τις δομές συντονισμού ενός μορίου;
Όταν σχεδιάζετε δομές συντονισμού, ακολουθούν μερικά πράγματα που θέλετε να έχετε κατά νου:
- Μετακινήστε μόνο τα ηλεκτρόνια (ποτέ μετακινήστε τα άτομα).
- Σε αυτό περιλαμβάνονται ηλεκτρόνια μοναχικού ζεύγους και δεσμοί pi (θυμηθείτε:Υπάρχει ένας δεσμός pi σε έναν διπλό δεσμό και δύο δεσμοί pi σε έναν τριπλό δεσμό.)
- Ποτέ σπάσει έναν μεμονωμένο δεσμό (γνωστός και ως δεσμός σίγμα).
- Εργαστείτε σε μία περιοχή τη φορά.
- Αυτό σημαίνει να εστιάσετε στα τρία άτομα που βρίσκονται πιο κοντά μεταξύ τους και να κατεβείτε το μόριο.
- Θα θέλετε να ξεκινήσετε στις περιοχές με πυκνότητα ηλεκτρονίων.
- Αυτό σημαίνει ότι θα ωθήσετε τα ηλεκτρόνια από το αρνητικό φορτίο στο θετικό.
- Συνήθως, θα μετατρέπετε τα μοναχικά ζεύγη σε δεσμούς και τα ομόλογα σε μοναχικά ζεύγη.
- Ακολουθήστε τον κανόνα της οκτάδας και προσπαθήστε να μείνετε μακριά από μεγάλες επίσημες χρεώσεις.
Παράδειγμα:Πώς θα σχεδιάζατε τις δομές συντονισμού του όζοντος (O3 )?
Τι είναι το όζον;
Αρχικά, ας ρίξουμε μια ματιά στο όζον. Πιθανότατα έχετε ακούσει για το στρώμα του όζοντος στη στρατόσφαιρα της γης. Ο λόγος που ονομάζεται «στοιβάδα του όζοντος» είναι λόγω της υψηλής συγκέντρωσης όζοντος, το οποίο απορροφά το μεγαλύτερο μέρος της υπεριώδους ακτινοβολίας του ήλιου. Στη χημεία, είναι ένας από τους πιο ισχυρούς οξειδωτικούς παράγοντες καθώς έχει μεγάλο τυπικό δυναμικό μείωσης.
Σχεδιάζοντας τη δομή του όζοντος Lewis
Για να βρούμε τη δομή συντονισμού του όζοντος, θα σχεδιάσουμε τη δομή lewis του όζοντος. Αφού ο μοριακός τύπος είναι O3 , γνωρίζουμε ότι υπάρχουν 18 ηλεκτρόνια σθένους (το οξυγόνο έχει έξι ηλεκτρόνια σθένους ως 6 x 3=18). Αφού τοποθετήσουμε όλα τα ηλεκτρόνια, θα έχουμε έναν διπλό δεσμό και έναν απλό δεσμό.
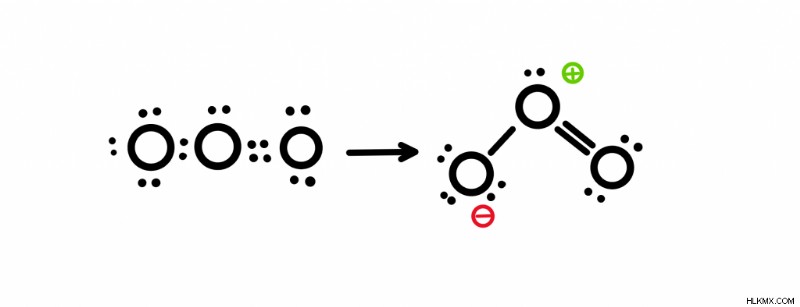
Σχεδίαση της δομής συντονισμού
Παρατηρήστε ότι υπάρχει ένα θετικό τυπικό φορτίο στο επάνω οξυγόνο και ένα αρνητικό στο οξυγόνο στα αριστερά του. Για να βρείτε τα τυπικά φορτία, μετρήστε τον αριθμό των ηλεκτρονίων που κατέχει το άτομο και να το συγκρίνουμε με τα ηλεκτρόνια σθένους του. Για παράδειγμα, το κορυφαίο οξυγόνο έχει 5 ηλεκτρόνια. Τα 2 από τα ηλεκτρόνια είναι ένα μοναχικό ζεύγος και τα άλλα 3 προέρχονται από τους δεσμούς. Θυμηθείτε, κατέχει μόνο ένα από τα ηλεκτρόνια σε έναν δεσμό. Επομένως, 6 – 5=+1. Το ίδιο ισχύει και για το οξυγόνο του πυθμένα. Κάτω αριστερά έχει 7 ηλεκτρόνια και 6 – 7=-1. Για να βρείτε τον αριθμό των ηλεκτρονίων σθένους, ανατρέξτε στον αριθμό της ομάδας στην κορυφή του περιοδικού πίνακα.
Βήμα 1:Μεταφέρετε τα ηλεκτρόνια στο οξυγόνο με το αρνητικό φορτίο και μετατρέψτε το σε διπλό δεσμό.
Βήμα 2:Σπάστε τον διπλό δεσμό μεταξύ του θετικού οξυγόνου και του ουδέτερου οξυγόνου. Τοποθετήστε τα δύο ηλεκτρόνια που ήταν κάποτε σε έναν απλό δεσμό στο οξυγόνο στα δεξιά.
Βήμα 3:Τώρα προσθέστε ένα αρνητικό φορτίο στο οξυγόνο κάτω δεξιά, καθώς τώρα έχει τυπικό φορτίο -1.
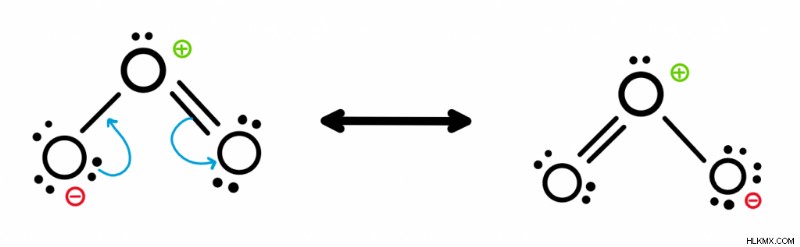
Παρατηρήστε πώς το βέλος που χωρίζει τις δομές έχει δύο κεφαλές. Οι δομές συντονισμού το χρησιμοποιούν για να δείξουν τη ροή των ηλεκτρονίων που πηγαίνουν εμπρός και πίσω. Μόλις δεν μπορείτε να δημιουργήσετε μια νέα μοναδική δομή συντονισμού, μπορείτε να σταματήσετε.
Πώς προσδιορίζετε την πιο σταθερή δομή συντονισμού;
Οι δομές συντονισμού με τη χαμηλότερη ποσότητα ενέργειας είναι γνωστό ότι είναι οι πιο σταθερές. Αυτό είναι σημαντικό γιατί όσο μεγαλύτερη είναι η σταθερότητα μιας μοναδικής δομής, τόσο περισσότερο θα συμβάλει στο υβρίδιο συντονισμού. Οι πιο σταθερές δομές είναι γνωστές ως μείζονες συνεισφέροντες . Εν τω μεταξύ, οι λιγότερο σταθερές δομές είναι γνωστές ως μικροί συνεισφέροντες . Για να μάθετε ποια δομή συντονισμού είναι η πιο σταθερή, υπάρχουν πέντε βασικοί κανόνες που πρέπει να ακολουθήσετε. (Σημείωση:αν δύο δομές είναι ίσες, θα συνεισφέρουν εξίσου.)
Κανόνες σταθερότητας συντονισμού:
- Το υβρίδιο συντονισμού είναι πιο σταθερό από οποιαδήποτε μοναδική δομή.
- Η δομή χωρίς χρέωση είναι πιο σταθερή από οποιαδήποτε δομή με φορτία.
- Η δομή με τον μικρότερο αριθμό τυπικών χρεώσεων είναι πιο σταθερή από εκείνες με περισσότερες
- Η πιο σταθερή δομή θα έχει το αρνητικό φορτίο τοποθετείται στο πιο ηλεκτραρνητικό άτομο .
- Η πιο σταθερή δομή θα έχει το θετικό φορτίο τοποθετείται στο λιγότερο ηλεκτραρνητικό άτομο.
Παράδειγμα:Ποιες δομές είναι οι πιο σταθερές;
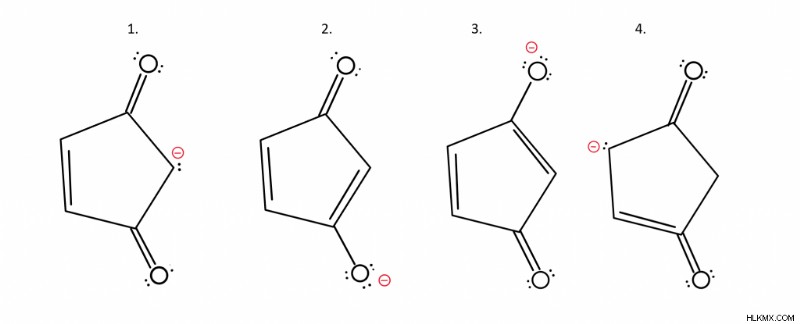
Το πρώτο πράγμα που πρέπει να προσέξετε είναι ότι το αρνητικό φορτίο βρίσκεται σε διαφορετική περιοχή για κάθε δομή. Επιστρέφοντας σε αυτό που γνωρίζουμε, η πιο σταθερή δομή θα έχει το αρνητικό φορτίο στο πιο ηλεκτραρνητικό άτομο. Σε αυτή την περίπτωση, έχουμε δύο διαφορετικά άτομα:οξυγόνο και άνθρακα. Ποιο είναι πιο ηλεκτραρνητικό; Αν είπες οξυγόνο έχεις δίκιο. Επομένως, οι δομές 2 και 3 είναι πιο σταθερές από τις 1 και 4.
Ποια είναι πιο σταθερή, η δομή 2 ή η δομή 3;
Η απάντηση είναι ότι είναι ίσοι και, ως εκ τούτου, θα συνεισφέρουν εξίσου ως κύριοι συνεισφέροντες.
Περαιτέρω ανάγνωση:
Παραγγελία ομολόγου έναντι μήκους ομολόγου
Μοριακός vs Εμπειρικός τύπος




