Διαφορά μεταξύ της πολικότητας του δεσμού και της μοριακής πολικότητας
Κύρια διαφορά – Πολικότητα δεσμού έναντι μοριακής πολικότητας
Στη χημεία, η πολικότητα είναι ο διαχωρισμός των ηλεκτρικών φορτίων που οδηγούν ένα μόριο σε μια διπολική ροπή. Εδώ, μερικώς θετικά και μερικώς αρνητικά ηλεκτρικά φορτία διαχωρίζονται είτε σε δεσμό είτε σε μόριο. Αυτό συμβαίνει κυρίως λόγω των διαφορών στις τιμές ηλεκτραρνητικότητας των ατόμων. Η ηλεκτροαρνητικότητα ενός ατόμου είναι ένα μέτρο του βαθμού έλξης ηλεκτρονίων. Όταν δύο άτομα συνδέονται μεταξύ τους μέσω ομοιοπολικού δεσμού, τα ηλεκτρόνια του δεσμού έλκονται προς το πιο ηλεκτραρνητικό άτομο. Αυτό δίνει σε αυτό το άτομο ένα μερικό αρνητικό φορτίο λόγω της υψηλής πυκνότητας ηλεκτρονίων γύρω του. Αντίστοιχα, τα άλλα άτομα αποκτούν μερικό θετικό φορτίο. Το τελικό αποτέλεσμα είναι ένας πολικός δεσμός. Αυτό περιγράφεται από την πολικότητα του δεσμού. Η μοριακή πολικότητα είναι η πολικότητα ολόκληρου του μορίου. Η κύρια διαφορά μεταξύ της πολικότητας του δεσμού και της μοριακής πολικότητας είναι ότι η πολικότητα δεσμού εξηγεί την πολικότητα ενός ομοιοπολικού δεσμού ενώ η μοριακή πολικότητα εξηγεί την πολικότητα ενός ομοιοπολικού μορίου.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Bond Polarity
– Ορισμός, πολικότητα, εξήγηση με παραδείγματα
2. Τι είναι η μοριακή πολικότητα
– Ορισμός, πολικότητα, εξήγηση με παραδείγματα
3. Ποια είναι η διαφορά μεταξύ της πολικότητας του δεσμού και της μοριακής πολικότητας
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Άτομα, Ομοιοπολική, Διπολικές Ροπές, Ηλεκτρόνιο, Ηλεκτραρνητικότητα, Μη πολικός, Πολικός, Πολικός δεσμός

Τι είναι η πολικότητα ομολόγου
Η πολικότητα του δεσμού είναι μια έννοια που εξηγεί την πολικότητα των ομοιοπολικών δεσμών. Οι ομοιοπολικοί δεσμοί σχηματίζονται όταν δύο άτομα μοιράζονται τα ασύζευκτα ηλεκτρόνια τους. Τότε, τα ηλεκτρόνια του δεσμού ή τα ηλεκτρόνια που εμπλέκονται στον δεσμό, ανήκουν και στα δύο άτομα. Ως εκ τούτου, υπάρχει μια πυκνότητα ηλεκτρονίων μεταξύ δύο ατόμων.
Αν τα δύο άτομα είναι του ίδιου χημικού στοιχείου, τότε δεν μπορεί να παρατηρηθεί πολικότητα δεσμού, καθώς και τα δύο άτομα δείχνουν ίση έλξη στα ηλεκτρόνια του δεσμού. Αλλά αν τα δύο άτομα ανήκουν σε δύο διαφορετικά χημικά στοιχεία, το πιο ηλεκτραρνητικό άτομο θα προσελκύσει τα ηλεκτρόνια του δεσμού από το λιγότερο ηλεκτραρνητικό άτομο. Στη συνέχεια, το λιγότερο ηλεκτραρνητικό άτομο παίρνει ένα μερικό θετικό φορτίο αφού η πυκνότητα ηλεκτρονίων γύρω από αυτό το άτομο μειώνεται. Αλλά το πιο ηλεκτραρνητικό άτομο παίρνει ένα μερικό αρνητικό φορτίο επειδή η πυκνότητα ηλεκτρονίων γύρω από αυτό το άτομο είναι υψηλή. Αυτός ο διαχωρισμός φορτίου είναι γνωστός ως πολικότητα δεσμού σε ομοιοπολικούς δεσμούς.
Όταν υπάρχει διαχωρισμός φορτίου, αυτός ο δεσμός είναι γνωστός ως πολικός δεσμός. Ελλείψει πολικότητας δεσμού, είναι γνωστός ως μη πολικός δεσμός. Ας εξετάσουμε δύο παραδείγματα για να κατανοήσουμε την πολικότητα του δεσμού.
Παραδείγματα πολικότητας δεσμών
CF
Εδώ, το C είναι λιγότερο ηλεκτραρνητικό από το άτομο F. Επομένως τα ηλεκτρόνια του δεσμού έλκονται περισσότερο προς το άτομο F. Στη συνέχεια, το άτομο F αποκτά μερικό αρνητικό φορτίο ενώ το άτομο C λαμβάνει ένα μερικό θετικό φορτίο.
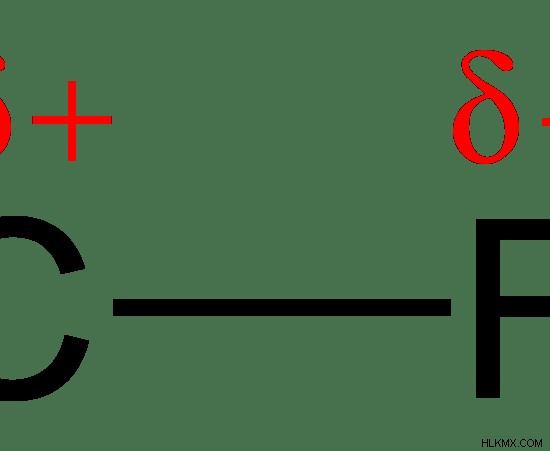
Εικόνα 1:ΚΙ
H2
Εδώ, δύο άτομα H συνδέονται μεταξύ τους μέσω ενός ομοιοπολικού δεσμού. Δεδομένου ότι και τα δύο άτομα έχουν την ίδια ηλεκτραρνητικότητα, δεν υπάρχει καθαρή έλξη από ένα άτομο. Επομένως, αυτός είναι ένας μη πολικός δεσμός χωρίς διαχωρισμό φορτίου.
Τι είναι η Μοριακή Πολικότητα
Η μοριακή πολικότητα είναι μια έννοια που εξηγεί την πολικότητα των ομοιοπολικών ενώσεων. Εδώ, εξετάζεται ο συνολικός διαχωρισμός φορτίου σε ένα μόριο. Για αυτό, χρησιμοποιείται η πολικότητα κάθε ομοιοπολικού δεσμού που υπάρχει στο μόριο.
Σύμφωνα με τη μοριακή πολικότητα, οι ενώσεις μπορούν να ταξινομηθούν ως πολικές και μη πολικές ενώσεις. Η μοριακή πολικότητα δημιουργεί διπολικές ροπές στα μόρια. Μια διπολική ροπή ενός μορίου είναι η δημιουργία ενός διπόλου με διαχωρισμό δύο αντίθετων ηλεκτρικών φορτίων.
Η μοριακή πολικότητα εξαρτάται κυρίως από τη μοριακή γεωμετρία. Όταν η μοριακή γεωμετρία είναι συμμετρική, δεν υπάρχει καθαρός διαχωρισμός φορτίου. Αλλά εάν η γεωμετρία είναι ασύμμετρη, υπάρχει καθαρός διαχωρισμός φορτίου. Ας εξετάσουμε ένα παράδειγμα για να εξηγήσουμε αυτήν την έννοια.
Παραδείγματα μοριακής πολικότητας
H2 O
Ένα μόριο νερού έχει διπολική ροπή λόγω του διαχωρισμού φορτίου. Εκεί, το οξυγόνο είναι πιο ηλεκτραρνητικό από τα άτομα υδρογόνου. Ως εκ τούτου, τα ηλεκτρόνια του δεσμού έλκονται περισσότερο προς το άτομο οξυγόνου. Η μοριακή γεωμετρία του μορίου του νερού είναι ασύμμετρη:τριγωνική επίπεδη. Επομένως, το μόριο του νερού εμφανίζει μοριακή πολικότητα.

Εικόνα 2:H2 Ον
CO2
Αυτό το μόριο έχει δύο πολικούς δεσμούς C=O. Αλλά η μοριακή γεωμετρία είναι γραμμική. Τότε δεν υπάρχει διαχωρισμός καθαρής χρέωσης. Ως εκ τούτου CO2 είναι ένα μη πολικό μόριο.
Διαφορά μεταξύ πολικότητας δεσμού και μοριακής πολικότητας
Ορισμός
Πολικότητα δεσμού: Η πολικότητα δεσμού είναι μια έννοια που εξηγεί την πολικότητα των ομοιοπολικών δεσμών.
Μοριακή πολικότητα: Η μοριακή πολικότητα είναι μια έννοια που εξηγεί την πολικότητα των ομοιοπολικών ενώσεων.
Παράγοντες που επηρεάζουν την πολικότητα
Πολικότητα δεσμού: Η πολικότητα του δεσμού εξαρτάται από τις τιμές ηλεκτραρνητικότητας των ατόμων που εμπλέκονται στη σύνδεση.
Μοριακή πολικότητα: Η μοριακή πολικότητα εξαρτάται κυρίως από τη μοριακή γεωμετρία του μορίου.
Διαφορετικοί τύποι
Πολικότητα δεσμού: Η πολικότητα του δεσμού προκαλεί το σχηματισμό πολικών ομοιοπολικών δεσμών και μη πολικών ομοιοπολικών δεσμών.
Μοριακή πολικότητα: Η μοριακή πολικότητα προκαλεί το σχηματισμό πολικών ομοιοπολικών ενώσεων και μη πολικών ομοιοπολικών ενώσεων.
Συμπέρασμα
Η πολικότητα ενός δεσμού ή ενός μορίου είναι η έννοια που εξηγεί τον διαχωρισμό των ηλεκτρικών φορτίων. Η πολικότητα του δεσμού προκύπτει λόγω των διαφορών στις τιμές ηλεκτραρνητικότητας των ατόμων. Η μοριακή πολικότητα εξαρτάται κυρίως από τη γεωμετρία του μορίου. Ωστόσο, η κύρια διαφορά μεταξύ της πολικότητας του δεσμού και της μοριακής πολικότητας είναι ότι η πολικότητα του δεσμού εξηγεί την πολικότητα ενός ομοιοπολικού δεσμού ενώ η μοριακή πολικότητα εξηγεί την πολικότητα ενός ομοιοπολικού μορίου.