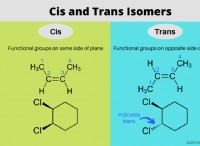
Πώς σχηματίζεται το ανθρακικό οξύ;
Εδώ είναι η χημική εξίσωση:
co₂ + h₂o ⇌ h₂co₃
Αυτή η αντίδραση είναι αναστρέψιμη , που σημαίνει ότι μπορεί να προχωρήσει και στις δύο κατευθύνσεις. Ωστόσο, υπό κανονικές συνθήκες, η ισορροπία βρίσκεται σε μεγάλο βαθμό στο αριστερά , που σημαίνει ότι υπάρχει πολύ πιο διαλυμένο CO₂ από το ανθρακικό οξύ σε διάλυμα.
Ακολουθεί μια ανάλυση της διαδικασίας:
1. Co₂ Διαλύεται στο νερό: Όταν το Co₂ έρχεται σε επαφή με το νερό, διαλύεται στο υγρό.
2. Ενυδάτωση: Μόλις διαλυθεί, το Co₂ αντιδρά με μόρια νερού για να σχηματίσει ανθρακικό οξύ.
3. Ισορροπία: Η αντίδραση φτάνει στην ισορροπία, όπου ο ρυθμός σχηματισμού ανθρακικού οξέος είναι ίσος με τον ρυθμό της κατάρρευσης του πίσω σε CO₂ και νερό.
Παράγοντες που επηρεάζουν τον σχηματισμό καρβονικού οξέος:
* Πίεση: Η υψηλότερη πίεση ευνοεί τον σχηματισμό ανθρακικού οξέος.
* Θερμοκρασία: Οι χαμηλότερες θερμοκρασίες ευνοούν τον σχηματισμό ανθρακικού οξέος.
* ph: Το χαμηλότερο ρΗ (πιο όξινο) ευνοεί τον σχηματισμό ανθρακικού οξέος.
Σημασία του ανθρακικού οξέος:
Το καρβονικό οξύ διαδραματίζει κρίσιμο ρόλο σε διάφορες βιολογικές και γεωλογικές διεργασίες, όπως:
* buffering αίματος: Βοηθά στη ρύθμιση του pH του αίματος.
* Οξίνιση των ωκεανών: Η απορρόφηση του ατμοσφαιρικού CO₂ στον ωκεανό σχηματίζει ανθρακικό οξύ, συμβάλλοντας στην οξίνιση των ωκεανών.
* Ορυκτό σχηματισμό ανθρακικού: Το ανθρακικό οξύ αντιδρά με μέταλλα για να σχηματίσουν ανθρακικά πετρώματα όπως ο ασβεστόλιθος.
Είναι σημαντικό να σημειωθεί ότι το ανθρακικό οξύ είναι ένα αδύναμο οξύ , που σημαίνει ότι μόνο εν μέρει ιονίζει σε διάλυμα. Αυτό σημαίνει ότι δεν απελευθερώνει εύκολα ιόντα υδρογόνου (H⁺), καθιστώντας το λιγότερο διαβρωτικό από τα ισχυρά οξέα όπως το υδροχλωρικό οξύ (HCl).