Πώς δείχνει μια χημική εξίσωση ότι έχει συμβεί η αντίδραση;
* Αντιδραστήρια: Αυτές είναι οι ουσίες που υπάρχουν πριν από την αντίδραση. Είναι γραμμένα στην αριστερή πλευρά της εξίσωσης.
* Προϊόντα: Αυτές είναι οι ουσίες που σχηματίζονται ως αποτέλεσμα της αντίδρασης. Είναι γραμμένα στη δεξιά πλευρά της εξίσωσης.
* βέλος: Το βέλος μεταξύ των αντιδραστηρίων και των προϊόντων υποδεικνύει την κατεύθυνση της αντίδρασης. Συνήθως δείχνει από αριστερά προς τα δεξιά, υποδηλώνοντας ότι τα αντιδραστήρια μετατρέπονται σε προϊόντα.
Εδώ είναι ένα παράδειγμα:
2H₂ + O₂ → 2H₂O
* Αντιδραστήρια: 2 μόρια υδρογόνου (Η) και 1 μόριο οξυγόνου (O₂)
* Προϊόντα: 2 μόρια νερού (H₂o)
* βέλος: Αυτό υποδεικνύει ότι το υδρογόνο και το οξυγόνο αντιδρούν για να σχηματίσουν νερό.
Βασικά σημεία:
* Εξισορρόπηση: Μια χημική εξίσωση πρέπει να είναι ισορροπημένη, πράγμα που σημαίνει ότι ο αριθμός των ατόμων κάθε στοιχείου στην πλευρά του αντιδραστηρίου πρέπει να ισούται με τον αριθμό των ατόμων αυτού του στοιχείου από την πλευρά του προϊόντος. Αυτό εξασφαλίζει ότι ο νόμος της διατήρησης της μάζας διατηρείται, ο οποίος δηλώνει ότι το θέμα δεν μπορεί να δημιουργηθεί ή να καταστραφεί σε χημική αντίδραση.
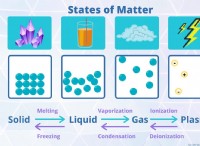
* καταστάσεις ύλης: Η φυσική κατάσταση κάθε αντιδραστηρίου και προϊόντος μπορεί να υποδεικνύεται χρησιμοποιώντας σύμβολα όπως (ες) για στερεά, (L) για υγρό, (g) για αέριο και (aq) για υδατικό διάλυμα.
* συνθήκες αντίδρασης: Μερικές φορές, πρόσθετες πληροφορίες σχετικά με τις συνθήκες αντίδρασης περιλαμβάνονται πάνω ή κάτω από το βέλος, όπως η θερμοκρασία, η πίεση ή οι καταλύτες.
Με την προσεκτική εξέταση της χημικής εξίσωσης, μπορούμε να κατανοήσουμε τις συγκεκριμένες αλλαγές που συμβαίνουν κατά τη διάρκεια της αντίδρασης, συμπεριλαμβανομένων:
* Σχηματισμός νέων ομολόγων: Οι χημικές αντιδράσεις περιλαμβάνουν το σπάσιμο και τη δημιουργία δεσμών μεταξύ των ατόμων, με αποτέλεσμα τη δημιουργία νέων μορίων.
* Αλλαγές στις χημικές ιδιότητες: Τα προϊόντα μιας αντίδρασης θα έχουν διαφορετικές χημικές ιδιότητες από τα αντιδραστήρια.
* Αλλαγές ενέργειας: Οι χημικές αντιδράσεις μπορούν να απελευθερώσουν ή να απορροφήσουν ενέργεια, η οποία αντικατοπτρίζεται στην αλλαγή ενθαλπίας της αντίδρασης.
Συνοπτικά, μια χημική εξίσωση παρέχει έναν συνοπτικό και ενημερωτικό τρόπο για να περιγραφεί ο μετασχηματισμός των αντιδραστηρίων σε προϊόντα, υποδεικνύοντας ότι έχει πραγματοποιηθεί χημική αντίδραση.