Διαφορά μεταξύ της ιδανικής λύσης και της μη ιδανικής λύσης
Κύρια διαφορά – Ιδανική λύση έναντι μη ιδανική λύση
Ιδανική λύση είναι μια λύση που έχει παρόμοιες ιδιότητες με ένα ιδανικό μείγμα αερίων. Ωστόσο, δεν υπάρχουν αλληλεπιδράσεις μεταξύ μορίων αερίου στα ιδανικά αέρια. Αλλά δεν μπορούμε να θεωρήσουμε το ίδιο σε διαλύματα γιατί τα μόρια σε διαλύματα θα πρέπει να έχουν διαμοριακές αλληλεπιδράσεις μεταξύ των μορίων για να θεωρηθούν ως υγρά. Επομένως, οι ιδανικές λύσεις διαφέρουν από τα ιδανικά αέρια λόγω της παρουσίας αλληλεπιδράσεων μεταξύ μορίων. Οι μη ιδανικές λύσεις είναι οι πραγματικές λύσεις που υπάρχουν παντού. Υπάρχουν όμως κάποιες λύσεις που έχουν παρόμοια συμπεριφορά με μια ιδανική λύση. Η κύρια διαφορά μεταξύ της ιδανικής λύσης και της μη ιδανικής λύσης είναι ότι οι διαμοριακές αλληλεπιδράσεις μεταξύ όλων των μορίων είναι ίδιες σε ιδανικές λύσεις, ενώ οι διαμοριακές αλληλεπιδράσεις μεταξύ μορίων διαλυμένης ουσίας και μορίων διαλύτη είναι διαφορετικές μεταξύ τους σε μη ιδανικά διαλύματα.
Βασικές περιοχές που καλύπτονται
1. Τι είναι η Ιδανική Λύση
– Χαρακτηριστικές ιδιότητες και ύπαρξη
2. Τι είναι μια μη ιδανική λύση
– Ιδιότητες και παραδείγματα
3. Ποια είναι η διαφορά μεταξύ της ιδανικής λύσης και της μη ιδανικής λύσης
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ιδανική λύση, Διαμοριακές αλληλεπιδράσεις, Μη ιδανική λύση, Λύση, Δυνάμεις Van Der Waal
Τι είναι η Ιδανική Λύση
Ιδανική λύση είναι μια λύση στην οποία οι αλληλεπιδράσεις μεταξύ των μορίων είναι πανομοιότυπες μεταξύ όλων των μορίων του διαλύματος. Δεν υπάρχει καθαρή δύναμη μεταξύ των συστατικών του διαλύματος. Έτσι, η απόσταση μεταξύ των μορίων μιας διαλυμένης ουσίας δεν αλλάζει μετά την ανάμειξή της με έναν διαλύτη. Αυτό συμβαίνει επειδή θα πρέπει να ασκείται μια δύναμη σε κάθε μόριο της διαλυμένης ουσίας προκειμένου να αλλάξει η απόσταση.
Η μεταβολή της ενθαλπίας μιας ιδανικής λύσης είναι μηδέν ή περίπου ίση με μηδέν. Αυτό σημαίνει ότι η ενθαλπία των αρχικών συστατικών είναι ίση με την ενθαλπία του διαλύματος μετά την ανάμιξη. Επομένως, η ενθαλπία για έλλειψη είναι μηδέν. 
Σχεδόν ιδανικές λύσεις υπάρχουν στην πραγματικότητα. Για παράδειγμα, το μείγμα βενζολίου και τολουολίου αποτελεί σχεδόν ιδανική λύση. Εδώ, οι αλληλεπιδράσεις μεταξύ βενζολίου-βενζολίου, βενζολίου-τολουολίου και τολουολίου-τολουολίου είναι σχεδόν πανομοιότυπες.
Τι είναι μια μη ιδανική λύση
Μια μη ιδανική λύση είναι μια λύση που έχει διαφορές στις αλληλεπιδράσεις μεταξύ μορίων διαφορετικών συστατικών στο διάλυμα. Μια μη ιδανική λύση μπορεί να αναγνωριστεί με τον προσδιορισμό της ισχύος των διαμοριακών δυνάμεων. Οι ιδιότητες ενός μη ιδανικού διαλύματος μπορεί να εξαρτώνται από τις αλληλεπιδράσεις διαλύτη-διαλύτη, διαλύτη-διαλυμένης ουσίας και διαλυμένης ουσίας. Εάν οι αλληλεπιδράσεις διαλύτη-διαλυμένης ουσίας είναι υψηλότερες από άλλους δύο τύπους αλληλεπιδράσεων, τότε η διαλυμένη ουσία είναι καλά διαλυτή σε αυτόν τον διαλύτη. Το μείγμα που προκύπτει είναι μια μη ιδανική λύση.
Ωστόσο, οι πολύ αραιωμένες λύσεις δείχνουν συμπεριφορά ιδανικής λύσης περισσότερο από τη συμπεριφορά μη ιδανικής λύσης. Αυτό συμβαίνει επειδή, η ποσότητα των μορίων της διαλυμένης ουσίας σε ένα αραιό διάλυμα είναι μικρότερη με αποτέλεσμα μικρότερη έλξη μεταξύ των μορίων της διαλυμένης ουσίας. Αλλά σε συμπυκνωμένα διαλύματα, υπάρχουν περισσότερα μόρια διαλυμένης ουσίας. Τότε υπάρχουν ισχυρότερες αλληλεπιδράσεις μεταξύ των μορίων της διαλυμένης ουσίας. Τα συμπυκνωμένα διαλύματα παρουσιάζουν μη ιδανική συμπεριφορά λύσης.
Η αλλαγή της ενθαλπίας ανάμειξης των διαλυμένων ουσιών με τον διαλύτη είναι υψηλότερη τιμή. Αυτό σημαίνει ότι η αρχική ενθαλπία των διαλυμένων ουσιών και του διαλύτη είναι είτε πολύ υψηλή είτε πολύ χαμηλότερη από την ενθαλπία του τελικού διαλύματος.
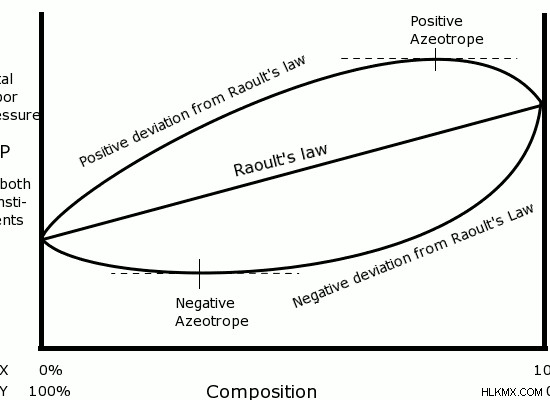
Εικόνα 2:Πώς λειτουργεί ο νόμος του Raoult σε ιδανικές και μη ιδανικές λύσεις
Η παραπάνω εικόνα δείχνει το διάγραμμα πίεσης απόκλισης του Raoult. Όπως φαίνεται στο διάγραμμα, μπορεί να υπάρχουν δύο τύποι μη ιδανικών λύσεων:λύσεις που παρουσιάζουν αρνητική απόκλιση από τις ιδανικές λύσεις και λύσεις που παρουσιάζουν θετική απόκλιση από τις ιδανικές λύσεις. Η αρνητική απόκλιση προκαλείται όταν τα μόρια της διαλυμένης ουσίας έλκονται περισσότερο μεταξύ τους παρά έλκονται από τα μόρια του διαλύτη. Μια θετική απόκλιση εμφανίζεται όταν οι έλξεις διαλυμένης ουσίας-διαλύτη είναι υψηλότερες από τις έλξεις μεταξύ παρόμοιων μορίων.
Διαφορά μεταξύ της ιδανικής λύσης και της μη ιδανικής λύσης
Ορισμός
Ιδανική λύση: Μια ιδανική λύση είναι μια λύση όπου οι αλληλεπιδράσεις μεταξύ των μορίων είναι πανομοιότυπες μεταξύ όλων των μορίων του διαλύματος.
Μη ιδανική λύση: Μια μη ιδανική λύση είναι μια λύση που έχει διαφορές στις αλληλεπιδράσεις μεταξύ μορίων διαφορετικών συστατικών στο διάλυμα.
Τύποι αλληλεπιδράσεων
Ιδανική λύση: Οι ιδανικές λύσεις έχουν πανομοιότυπες αλληλεπιδράσεις μεταξύ όλων των μορίων όλων των συστατικών.
Μη ιδανική λύση: Τα μη ιδανικά διαλύματα έχουν αλληλεπιδράσεις διαλύτη-διαλύτου, διαλύτη-διαλυμένης ουσίας και διαλυμένης ουσίας.
Ενθαλπία
Ιδανική λύση: Η μεταβολή της ενθαλπίας όταν σχηματίζεται ένα ιδανικό διάλυμα είναι μηδέν ή περίπου μηδέν.
Μη ιδανική λύση: Η αλλαγή στην ενθαλπία όταν σχηματίζεται μια μη ιδανική λύση είναι είτε θετική είτε αρνητική τιμή.
Πραγματικές λύσεις
Ιδανική λύση: Τα πολύ αραιωμένα διαλύματα μπορούν να συμπεριφέρονται ως ιδανικά διαλύματα.
Μη ιδανική λύση: Οι συμπυκνωμένες λύσεις συμπεριφέρονται ως μη ιδανικές λύσεις.
Συμπέρασμα
Αν και δεν υπάρχουν ιδανικά αέρια, ιδανικές λύσεις μπορεί να υπάρχουν στην πραγματικότητα. Το εξαιρετικά αραιωμένο διάλυμα συμπεριφέρεται επίσης ως ιδανικά διαλύματα λόγω των λιγότερων αλληλεπιδράσεων μεταξύ μορίων διαλυμένης ουσίας και μορίων διαλυμένης ουσίας-διαλύτη. Η κύρια διαφορά μεταξύ της ιδανικής λύσης και της μη ιδανικής λύσης είναι ότι οι διαμοριακές αλληλεπιδράσεις μεταξύ όλων των μορίων είναι οι ίδιες σε ιδανικά διαλύματα, ενώ οι διαμοριακές αλληλεπιδράσεις μεταξύ μορίων διαλυμένης ουσίας και μορίων διαλύτη είναι διαφορετικές μεταξύ τους σε μη ιδανικά διαλύματα.




