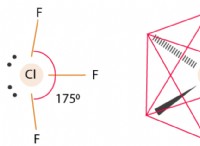
Ποια είναι η αντιδραστικότητα του χλωρίου στοιχείου;
* Διαμόρφωση ηλεκτρονίων: Το χλώριο έχει επτά ηλεκτρόνια σθένους, πράγμα που σημαίνει ότι χρειάζεται μόνο ένα ακόμη ηλεκτρόνιο για να επιτύχει μια σταθερή ρύθμιση οκτάδων. Αυτό το καθιστά εξαιρετικά ηλεκτροαρνητικό και πρόθυμο να κερδίσει ένα ηλεκτρόνιο.
* Ισχυρό οξειδωτικό παράγοντα: Το χλώριο δέχεται εύκολα ηλεκτρόνια από άλλα στοιχεία, καθιστώντας το ισχυρό οξειδωτικό παράγοντα. Αυτό σημαίνει ότι μπορεί εύκολα να προκαλέσει άλλα στοιχεία να χάσουν ηλεκτρόνια, οδηγώντας σε χημικές αντιδράσεις.
* Αντιδραστικότητα με μέταλλα: Το χλώριο αντιδρά εύκολα με τα περισσότερα μέταλλα, σχηματίζοντας χλωρίδια μετάλλων. Για παράδειγμα, αντιδρά με νάτριο για να σχηματίσει χλωριούχο νάτριο (επιτραπέζιο αλάτι).
* Αντιδραστικότητα με μη μέταλλα: Το χλώριο αντιδρά επίσης με πολλά μη μέταλλα, σχηματίζοντας ομοιοπολικές ενώσεις. Για παράδειγμα, αντιδρά με υδρογόνο για να σχηματίσει υδρογόνο χλωριούχο (HCl).
Συνέπειες της αντιδραστικότητας του χλωρίου:
* Bleach: Το χλώριο χρησιμοποιείται σε λευκαντικό για να οξειδώσει και να διασπάσει τις έγχρωμες ενώσεις, καθιστώντας τους άχρωμες.
* απολυμαντικό: Το χλώριο είναι ένα ισχυρό απολυμαντικό λόγω της ικανότητάς του να σκοτώνει βακτήρια και ιούς.
* Βιομηχανικές χρήσεις: Το χλώριο χρησιμοποιείται σε μια μεγάλη ποικιλία βιομηχανικών διεργασιών, συμπεριλαμβανομένης της παραγωγής πλαστικών, φυτοφαρμάκων και φαρμακευτικών προϊόντων.
Προφυλάξεις ασφαλείας:
Το αέριο χλωρίου είναι τοξικό και μπορεί να είναι επικίνδυνο εάν εισπνέεται. Είναι σημαντικό να χειριστείτε το χλώριο με προσοχή και να ακολουθήσετε τις διαδικασίες ασφαλείας όταν εργάζεστε με αυτό.