Διάλυμα εναντίον Διαλύτη:Ποια είναι η διαφορά;
Ποια είναι η διαφορά μεταξύ ενός διαλύτη και μιας διαλυμένης ουσίας; Τόσο ο διαλύτης όσο και η διαλυμένη ουσία είναι μέρη ενός διαλύματος. Τα διαλύματα είναι μείγματα δύο ή περισσότερων ουσιών και η ουσία που διαλύεται στο διάλυμα είναι διαλυμένη ουσία. Εν τω μεταξύ, η διαλυμένη ουσία διαλύεται σε μια ουσία που ονομάζεται διαλύτης. Οι διαλυμένες ουσίες και οι διαλύτες αναμιγνύονται μεταξύ τους για να σχηματίσουν πολλά διαφορετικά προϊόντα/διαλύματα όπως καφές, σαπούνι, αλοιφή και μια ποικιλία φαρμάκων.
Άλλοι σημαντικοί όροι που σχετίζονται με διαλύματα περιλαμβάνουν «ομογενές μείγμα» και διαλυτότητα. Το ομογενές μείγμα περιγράφει ένα διάλυμα που έχει διαλύσει πλήρως τη διαλυμένη ουσία, έχοντας τη διαλυμένη ουσία ομοιόμορφα απλωμένη σε όλο το σώμα του διαλύματος. Η διαλυτότητα περιγράφει την ικανότητα μιας ουσίας να διαλύεται σε μια άλλη ουσία.
Ορισμός διαλυμένης ουσίας

Η διαλυμένη ουσία είναι η ουσία που διαλύεται σε διάλυμα. Ενώ οι περισσότερες διαλυμένες ουσίες είναι στερεές ενώσεις, μπορεί να είναι αέριο ή υγρό. Παραδείγματα διαλυμένων ουσιών περιλαμβάνουν ζάχαρη διαλυμένη σε νερό, αλάτι διαλυμένο στο θαλασσινό νερό και οξυγόνο διαλυμένο στον αέρα. Οι ελκτικές δυνάμεις μεταξύ του διαλύτη και της διαλυμένης ουσίας πρέπει να είναι αρκετά ισχυρές ώστε να ξεπεραστούν οι μοριακές δυνάμεις που συγκρατούν τα σωματίδια μαζί, εάν η διαλυμένη ουσία πρόκειται να διαλυθεί στον διαλύτη. Καθώς η διαλυμένη ουσία διαλύεται στον διαλύτη, πλησιάζει σε ένα σημείο που ονομάζεται κορεσμός. Στο σημείο κορεσμού, ο διαλύτης δεν μπορεί να διαλύσει πλέον τη διαλυμένη ουσία - ο διαλύτης έχει φτάσει στη μέγιστη συγκέντρωση των διαλυμένων ουσιών.
Ως παραδείγματα διαλυμένων ουσιών, εξετάστε πώς διαλύεται η ζάχαρη στο νερό. Η ζάχαρη μπορεί να χρησιμοποιηθεί για να γλυκάνει το τσάι και το κάνει συνδυάζοντας με το νερό και σχηματίζοντας ένα διάλυμα. Η ζάχαρη είναι ότι η διαλυμένη ουσία και το τσάι ο διαλύτης. Ένα άλλο παράδειγμα είναι το ανθρακούχο νερό, και εδώ το νερό είναι διαλύτης και το CO2 η διαλυμένη ουσία, και όταν το H2O και το CO2 συνδυάζονται σχηματίζουν ανθρακικό οξύ, το οποίο είναι υπεύθυνο για να δώσει στο ανθρακούχο νερό την ελαφριά οξύτητά του.
Αξιοσημείωτα χαρακτηριστικά των διαλυμένων ουσιών:Οι διαλυμένες ουσίες μπορεί να είναι είτε αέριες, υγρές ή στερεές, αν και συχνά είναι στερεές. Οι διαλυμένες ουσίες έχουν συνήθως υψηλότερα σημεία βρασμού από τους διαλύτες. Η διαλυτότητα των αέριων διαλυμένων ουσιών επηρεάζεται από την πίεση του περιβάλλοντος, εκτός από τη θερμοκρασία και τον όγκο. Η διαλυτότητα κάποιου στοιχείου αυξάνεται όταν αυξάνεται η επιφάνεια των σωματιδίων της διαλυμένης ουσίας.
Ορισμός διαλύτη

Ο διαλύτης είναι αυτός στον οποίο διαλύεται η διαλυμένη ουσία. Ένας άλλος τρόπος ορισμού του διαλύτη είναι η ουσία που διαλύει διάφορες ενώσεις ή ουσίες για να γίνει διάλυμα. Το μεγαλύτερο μέρος ενός διαλύματος αποτελείται από τον διαλύτη, με τη διαλυμένη ουσία να περιλαμβάνει μόνο ένα μικρό μέρος του διαλύματος. Οι διαλύτες είναι συνήθως υγροί, αν και μπορεί να είναι άλλες μορφές ύλης. Ένας από τους πιο συνηθισμένους διαλύτες στον κόσμο είναι το νερό και μπορεί να διαλύει σχεδόν οποιαδήποτε ουσία, δίνοντάς του την ονομασία καθολικός διαλύτης.
Όταν εξετάζετε ποιες ουσίες μπορούν να διαλυθούν σε άλλες ουσίες, μια ευρετική που μπορείτε να χρησιμοποιήσετε είναι η ιδέα ότι "όπως διαλύεται όπως". Αυτό αναφέρεται στο γεγονός ότι οι πολικές ουσίες διαλύουν πιο εύκολα άλλες πολικές ουσίες, ενώ οι μη πολικές ουσίες διαλύουν πιο εύκολα άλλες μη πολικές ουσίες.
Οι πολικοί διαλύτες είναι οι διαλύτες που διαθέτουν ένα ή περισσότερα ηλεκτραρνητικά άτομα (όπως Ο, Ν ή Η) και διαθέτουν υψηλή διηλεκτρική σταθερά. Παραδείγματα πολικών διαλυτών περιλαμβάνουν καρβοξυλικά οξέα, κετόνες, αλκοόλες και αμίδια. Οι πολικοί διαλύτες μπορούν να υποδιαιρεθούν σε δύο διαφορετικές κατηγορίες, τους πολικούς πρωτικούς διαλύτες και τους πολικούς απρωτικούς διαλύτες. Τα πολικά πρωτικά μόρια περιλαμβάνουν μόρια όπως η μεθανόλη και το νερό και αυτά τα μόρια μπορούν να δημιουργήσουν δεσμούς υδρογόνου με διαλυμένες ουσίες. Αντίθετα, ένα παράδειγμα πολικού απρωτικού διαλύτη είναι η ακετόνη, η οποία δεν μπορεί να σχηματίσει δεσμούς υδρογόνου με διαλυμένες ουσίες. Εάν ένα μόριο όπως η ακετόνη συνδυάζεται με μια διαλυμένη ουσία, προκύπτουν αντ' αυτού αλληλεπιδράσεις διπόλου-διπόλου.
Μη πολικοί διαλύτες είναι εκείνοι που έχουν δεσμούς που περιέχουν άτομα παρόμοιας ηλεκτραρνητικότητας όπως H και C. Η δομή σημαίνει ότι οι μη πολικές ενώσεις μπορούν εύκολα να διαλυθούν από μη πολικά μόρια.
Στα αξιοσημείωτα χαρακτηριστικά των διαλυτών περιλαμβάνονται τα ακόλουθα:
- Οι διαλύτες έχουν συνήθως χαμηλά σημεία βρασμού και γι' αυτό εξατμίζονται εύκολα σε σύγκριση με τις διαλυμένες ουσίες.
- Ενώ οι διαλύτες μπορεί να είναι αέριο ή στερεό, είναι συχνά υγροί.
- Οι κοινοί διαλύτες έχουν συχνά άτομα άνθρακα μέσα τους και οι εν λόγω διαλύτες άνθρακα αναφέρονται ως οργανικοί διαλύτες.
- Οι διαλύτες χωρίς το στοιχείο άνθρακα ονομάζονται ανόργανοι διαλύτες.
- Παραδείγματα οργανικών διαλυτών περιλαμβάνουν βενζόλιο, βενζίνη, ακετόνη, αλκοόλη και ξυλόλιο.
- Οι διαλύτες παίζουν ρόλο στη ρύθμιση της θερμοκρασίας του διαλύματος, είτε αυξάνοντας την ταχύτητα στην οποία συμβαίνει η αντίδραση με τη διαλυμένη ουσία είτε απορροφώντας τη θερμότητα που παράγεται κατά τη διάρκεια της χημικής αντίδρασης.
Επισκόπηση των διαφορών μεταξύ διαλυτών και διαλυμένων ουσιών
Ανακεφαλαιώνοντας, οι διαλυμένες ουσίες είναι ουσίες που διαλύονται από τον διαλύτη, τήκοντας στο διάλυμα. Ο διαλύτης είναι αυτός που διαλύει τη διαλυμένη ουσία, και για το λόγο αυτό, υπάρχει συνήθως πολύ περισσότερος διαλύτης από ό, τι υπάρχει σε ένα διάλυμα. Οι διαλυμένες ουσίες μπορούν να έρθουν σε αέρια, υγρή ή στερεή μορφή, και παρόλο που οι διαλύτες βρίσκονται κυρίως σε υγρές καταστάσεις, υπάρχουν και ορισμένοι αέριοι και στερεοί διαλύτες. Το σημείο βρασμού μιας διαλυμένης ουσίας πρέπει να είναι υψηλότερο από το σημείο βρασμού ενός διαλύτη και οι ιδιότητες του διαλύτη και της διαλυμένης ουσίας αλληλοεξαρτώνται η μία από την άλλη.
Μια ματιά στη διαλυτότητα
Η διαλυτότητα ενός αντικειμένου ή ουσίας αναφέρεται στη μέγιστη ποσότητα αυτής της ουσίας που μπορεί να διαλυθεί σε άλλη ουσία. Για να το θέσω αλλιώς, όταν ένας διαλύτης βρίσκεται σε ισορροπία, η διαλυτότητα μιας ουσίας είναι η μέγιστη ποσότητα διαλυμένης ουσίας που μπορεί να απορροφήσει. Όταν ένας διαλύτης απορροφά τη μέγιστη ποσότητα διαλυμένης ουσίας του, παράγει ένα κορεσμένο διάλυμα.
Υπό τις σωστές συνθήκες, ένα υπερκορεσμένο διάλυμα μπορεί να παραχθεί με διάλυση πρόσθετης διαλυμένης ουσίας πέρα από το σημείο διαλυτότητας ισορροπίας. Μόλις επιτευχθεί αυτό το σημείο υπερκορεσμού, η προσθήκη περισσότερης διαλυμένης ουσίας στο διάλυμα δεν θα αυξήσει τη συγκέντρωση του διαλύματος και η διαλυμένη ουσία που δεν μπορεί να διαχωριστεί θα αρχίσει να καταβυθίζεται (βλ. παρακάτω). Λάβετε υπόψη ότι παρόλο που μερικές φορές οι έννοιες συγχέονται, ο ρυθμός λύσης και η διαλυτότητα δεν είναι το ίδιο πράγμα. Ο ρυθμός διαλύματος περιγράφει πόσο γρήγορα ένας διαλύτης διαλύει μια διαλυμένη ουσία, ενώ η διαλυτότητα είναι η μέγιστη ποσότητα μιας ουσίας που μπορεί να διαλυθεί. Η διαλυτότητα δεν είναι επίσης ισοδύναμη με την ικανότητα μιας ουσίας να διαλύει μια άλλη ουσία όταν προκληθεί από χημικές αντιδράσεις. Το HCl μπορεί να διαλύσει το μεταλλικό ψευδάργυρο μέσω μιας διαδικασίας μετατόπισης με αποτέλεσμα της αντίδρασης μετατόπισης να είναι η απελευθέρωση αερίου υδρογόνου και ιόντων ψευδαργύρου στο διάλυμα. Έτσι, ενώ τα ιόντα ψευδαργύρου θεωρούνται διαλυτά στο οξύ, η διαλυτότητα του ψευδαργύρου δεν είναι παράγοντας στην αντίδραση.
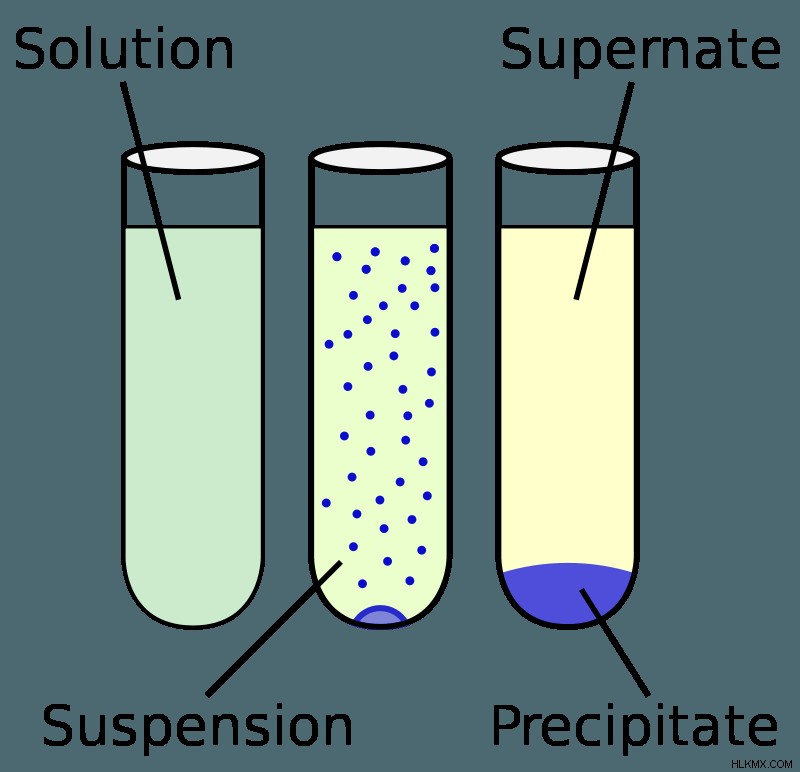
Μια ουσία λέγεται ότι είναι αδιάλυτη όταν διαλύεται ελάχιστα σε έναν διαλύτη, αν και ακόμη και οι περισσότερες αδιάλυτες ουσίες θα εξακολουθούν να διαλύονται κάπως. Υπάρχουν μόνο λίγες περιπτώσεις στις οποίες η διαλυμένη ουσία πρόκειται να διαλυθεί καθόλου. Γενικά, μια διαλυμένη ουσία θεωρείται αδιάλυτη εάν λιγότερο από 0,1 g της διαλυμένης ουσίας διαλύεται για κάθε 100 mL διαλύτη.
Οι τύποι χημικών δεσμών στη διαλυμένη ουσία και στον διαλύτη επηρεάζουν τον τρόπο διάλυσης της διαλυμένης ουσίας. Για παράδειγμα, δημιουργούνται νέοι δεσμοί υδρογόνου όταν συνδυάζονται μόρια αιθανόλης και νερού, παρόλο που τα φύλλα αιθανόλης έχουν μοριακή ταυτότητα όταν διαλύονται στο νερό (παραμένει ως αιθανόλη). Εξαιτίας αυτού, ο συνδυασμός του νερού και της αιθανόλης δημιουργεί συνολικά λιγότερο διάλυμα από ό,τι θα προέκυπτε από την απλή άθροιση των αρχικών όγκων νερού και αιθανόλης. Όταν ενώσεις όπως το χλωριούχο νάτριο, οι ιοντικές ενώσεις, διαλύονται στο νερό, η ένωση διασπάται στα ιόντα που την αποτελούν. Αυτά τα ιόντα έχουν μόρια νερού που τα περιβάλλουν και γίνονται διαλυτωμένα. Η δυναμική ισορροπία εμπλέκεται στη διαλυτότητα ενός διαλύματος, η οποία περιλαμβάνει τις αντίθετες διαδικασίες διάλυσης και καθίζησης. Η λύση θεωρείται ότι βρίσκεται σε ισορροπία όταν οι δύο διεργασίες συμβαίνουν με τον ίδιο ρυθμό.
Η διαλυτότητα διαφορετικών διαλυτών σε ενώσεις σε διάφορες θερμοκρασίες και άλλες συνθήκες παρατίθενται σε διαγράμματα και πίνακες διαλυτότητας. Η διαλυτότητα ορίζεται σε σχέση με την αναλογία μιας διαλυμένης ουσίας προς έναν διαλύτη, σύμφωνα με την IUPAC. Οι συγκεντρώσεις μπορούν να δοθούν σε μονάδες όπως μοριακότητα, μοριακότητα, μοριακά κλάσματα, μοριακή αναλογία, μάζα ανά όγκο κ.λπ. Η διαλυτότητα μιας ουσίας μπορεί να επηρεαστεί από διάφορους διαφορετικούς παράγοντες, όπως η πιθανή παρουσία άλλων χημικών ουσιών στο διάλυμα, η θερμοκρασία του διαλύματος, η πίεση, η φάση τόσο του διαλύτη όσο και της διαλυμένης ουσίας, η πολικότητα και το μέγεθος σωματιδίων της διαλυμένης ουσίας.
Σχετικά με τις αντιδράσεις κατακρήμνισης
Οι αντιδράσεις καθίζησης είναι ένας τύπος χημικής αντίδρασης όπου δύο διαλυτά άλατα συνδυάζονται μαζί σε ένα υδατικό διάλυμα και ένα από τα προκύπτοντα προϊόντα είναι ένα ίζημα (ένα αδιάλυτο άλας). Το ίζημα μπορεί να διαχωριστεί από το υπόλοιπο διάλυμα με διήθηση ή φυγοκέντρηση, ή μπορεί να πέσει έξω από το διάλυμα με την πάροδο του χρόνου ή ακόμα και να παραμείνει στη θέση του στο διάλυμα. Ο όρος για το υπόλοιπο υγρό μετά το σχηματισμό ενός ιζήματος είναι "υπερκείμενο". Η πιθανότητα ότι μια χημική αντίδραση θα σχηματίσει ίζημα επηρεάζεται από τη διαλυτότητα των εμπλεκόμενων ουσιών και η συμπεριφορά του διαλύματος μπορεί να προβλεφθεί συμβουλευόμενοι κανόνες διαλυτότητας ή έναν πίνακα διαλυτότητας. Γενικά, τα ιωδίδια, τα βρωμίδια και τα χλωρίδια είναι διαλυτά, όπως και τα νιτρικά, τα οξικά και τα υπερχλωρικά. Επίσης διαλυτές είναι ουσίες που περιέχουν κατιόντα αμμωνίου και άλατα αλκαλιμετάλλων.