Έχει το KCL υψηλότερο σημείο βρασμού από το CO2;
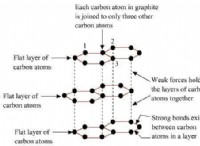
* ιονική εναντίον ομοιοπολικής σύνδεσης: Το KCl είναι μια ιοντική ένωση, που σημαίνει ότι σχηματίζεται από την ηλεκτροστατική έλξη μεταξύ θετικά φορτισμένων ιόντων καλίου (Κ+) και αρνητικά φορτισμένων ιόντων χλωριδίου (Cl-). Αυτοί οι ιοντικοί δεσμοί είναι πολύ ισχυροί. Το CO2 είναι μια ομοιοπολική ένωση, με άτομα άνθρακα και οξυγόνου που μοιράζονται ηλεκτρόνια. Οι ομοιοπολικοί δεσμοί είναι γενικά ασθενέστεροι από τους ιοντικούς δεσμούς.
* Διαμοριακές δυνάμεις: Οι ισχυροί ιοντικοί δεσμοί στην KCL οδηγούν σε ισχυρές ηλεκτροστατικές αλληλεπιδράσεις μεταξύ των ιόντων, απαιτώντας πολλή ενέργεια για να ξεπεραστούν και να προκαλέσουν τη βρασμό της ένωσης. Το CO2, από την άλλη πλευρά, βιώνει μόνο αδύναμες διαμοριακές δυνάμεις (δυνάμεις διασποράς του Λονδίνου) μεταξύ των μορίων του.
Σημεία βρασμού:
* kcl: 1420 ° C (2588 ° F)
* CO2: -78,5 ° C (-109,3 ° F)
Η σημαντική διαφορά στα σημεία βρασμού είναι ένα άμεσο αποτέλεσμα των διαφορών στη συγκόλληση και τις ενδομοριακές δυνάμεις.