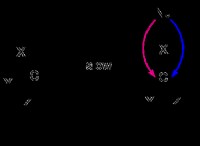
Όταν δύο άτομα χλωρίου συνδυάζονται μεταξύ τους ποιες μορφές δεσμού;
Εδώ είναι γιατί:
* Διαμόρφωση ηλεκτρονίων χλωρίου: Κάθε άτομο χλωρίου έχει 7 ηλεκτρόνια στο εξωτερικό κέλυφος του (κέλυφος σθένους). Χρειάζεται ένα ακόμη ηλεκτρόνιο για να επιτευχθεί μια σταθερή διαμόρφωση οκτάδων.
* Κοινή χρήση ηλεκτρόνων: Για να επιτευχθεί σταθερότητα, δύο άτομα χλωρίου μοιράζονται τα ηλεκτρόνια τους μεμονωμένα σθένος. Αυτή η κοινή χρήση αποτελεί έναν ενιαίο ομοιοπολικό δεσμό.
* Διατομικό μόριο: Το αποτέλεσμα είναι ένα διατομικό μόριο, cl 2 , όπου κάθε άτομο χλωρίου περιβάλλεται τώρα από οκτώ ηλεκτρόνια (δύο από το δικό του άτομο και έξι από τον κοινό δεσμό).