Παράδειγμα αραίωσης Προβλήματα
Στα περισσότερα εργαστηριακά περιβάλλοντα, δημιουργείται αποθεματικό διάλυμα όταν μια ένωση χρησιμοποιείται ξανά και ξανά. Αυτό το μητρικό διάλυμα θα έχει υψηλή συγκέντρωση. Εάν απαιτούνται χαμηλότερες συγκεντρώσεις, πραγματοποιείται αραίωση.
Η αραίωση είναι μια διαδικασία όπου η συγκέντρωση ενός διαλύματος μειώνεται με την προσθήκη διαλύτη στο διάλυμα χωρίς προσθήκη περισσότερης διαλυμένης ουσίας. Αυτά τα προβλήματα παραδείγματος αραίωσης δείχνουν πώς να εκτελούνται οι υπολογισμοί που απαιτούνται για τη δημιουργία ενός αραιωμένου διαλύματος.
Η βασική ιδέα πίσω από μια αραίωση είναι ότι ο αριθμός των mol της διαλυμένης ουσίας στα διαλύματα δεν αλλάζει καθώς προστίθεται ο διαλύτης.
moles διαλυμένης ουσίας πριν από την αραίωση =moles solute after dilution
Η συγκέντρωση ενός διαλύματος μπορεί να εκφραστεί σε μοριακότητα (Μ).
M =moles ανά λίτρο διαλύματος

όπου M είναι η μοριακότητα και V η συγκέντρωση.
Λύστε κρεατοελιές και πάρτε:
moles =MV
Δεδομένου ότι mole της διαλυμένης ουσίας πριν από την αραίωση =moles διαλυμένης ουσίας μετά την αραίωση,
Μi Vi =ΜΔ VD
όπου:
Μi =αρχική συγκέντρωση
Vi =αρχικός όγκος
ΜΔ =αραιωμένη συγκέντρωση
VD =αραιωμένος όγκος
Παράδειγμα Πρόβλημα 1:
Πρόβλημα: Τι όγκος NaOH 5 M χρειάζεται για να δημιουργηθεί ένα διάλυμα 10 mL NaOH;
Λύση: Χρησιμοποιήστε τον τύπο Mi Vi =ΜΔ VD .
Μi =5 Μ
Vi =αρχικός όγκος
ΜΔ =1 Μ
VD =100 mL
Λύση για Vi
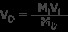

Vi =20 mL
Απάντηση: Απαιτούνται 20 mL NaOH 5 M για να δημιουργηθεί ένα διάλυμα 100 mL NaOH 1 M. Προστίθεται νερό στο διάλυμα των 20 mL μέχρι να γίνουν 100 mL.
Παράδειγμα Πρόβλημα 2:
Πρόβλημα: Εάν έχετε 300 mL NaCl 1,5 M, πόσα mL NaCl 0,25 M μπορείτε να φτιάξετε;
Λύση: Χρησιμοποιήστε τον τύπο Mi Vi =ΜΔ VD .
Μi =1,5 Μ
Vi =300 mL
ΜΔ =0,25 Μ
VD =τελικός τόμος
Λύση για VD
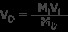

VD =1800 mL =1,8 L
Απάντηση: Μπορείτε να φτιάξετε 1800 mL διαλύματος NaCl 0,25 M από 300 mL διαλύματος NaCl 1,5 M.