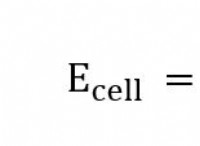Η σχετική μάζα μολύβδου των NaCl και C4H10 είναι περίπου ίδια. Ωστόσο, το σημείο βρασμού CL πάνω από 1000C υψηλότερο σημείο. Explian Γιατί;
* ιονική εναντίον ομοιοπολικής σύνδεσης: Το NaCl είναι μια ιοντική ένωση, που σημαίνει ότι σχηματίζει μια δομή κρυσταλλικού πλέγματος που συγκρατείται από ισχυρές ηλεκτροστατικές δυνάμεις μεταξύ θετικά φορτισμένων ιόντων νατρίου (Na⁺) και αρνητικά φορτισμένα ιόντα χλωριούχου (CL⁻). Το C₄H₁₀ (βουτάνιο) είναι μια ομοιοπολική ένωση, με μόρια που συγκρατούνται από σχετικά αδύναμες δυνάμεις van der Waals.
* Αντοχή των διαμοριακών δυνάμεων: Οι ηλεκτροστατικές δυνάμεις σε ιοντικές ενώσεις είναι σημαντικά ισχυρότερες από τις δυνάμεις van der Waals σε ομοιοπολικές ενώσεις. Αυτή η διαφορά στη δύναμη των διαμοριακών δυνάμεων είναι ο πρωταρχικός λόγος για την τεράστια ανισότητα του σημείου βρασμού.
Εδώ μεταφράζεται σε σημείο βρασμού:
* NaCl: Για να σπάσουμε τους ισχυρούς ιοντικούς δεσμούς στο NaCl και να τους προκαλέσει να βράσει, πρέπει να προμηθεύσετε μια τεράστια ποσότητα ενέργειας, με αποτέλεσμα ένα πολύ υψηλό σημείο βρασμού (πάνω από 1400 ° C).
* c₄h₁₀: Οι αδύναμες δυνάμεις van der Waals στο βουτάνιο ξεπερνούνται εύκολα με σχετικά μικρή ενέργεια, οδηγώντας σε ένα πολύ χαμηλότερο σημείο βρασμού (-0,5 ° C).
Συνοπτικά:
* NaCl: Ισχυροί ιοντικοί δεσμοί =υψηλά σημεία τήξης και βρασμού
* c₄h₁₀: Αδύναμες δυνάμεις van der waals =σημεία χαμηλής τήξης και βρασμού