Τι είδους δεσμό σχηματίζεται μεταξύ αλουμινίου και οξυγόνου;
Εδώ είναι γιατί:
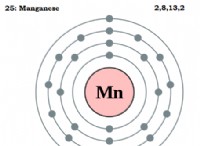
* Ηλεκτροργατιστικότητα: Το αλουμίνιο (AL) έχει ηλεκτροαρνητικότητα 1,61, ενώ το οξυγόνο (Ο) έχει ηλεκτροαρνητικότητα 3,44. Αυτή η μεγάλη διαφορά στην ηλεκτροαρνητικότητα σημαίνει ότι το οξυγόνο έχει πολύ ισχυρότερη έλξη για ηλεκτρόνια από το αλουμίνιο.
* Μεταφορά ηλεκτρονίων: Όταν αντιδρούν το αλουμίνιο και το οξυγόνο, τα άτομα οξυγόνου αποκτούν ηλεκτρόνια από άτομα αλουμινίου. Αυτό έχει ως αποτέλεσμα το σχηματισμό ιόντων αλουμινίου (al³⁺) και ιόντων οξειδίου (O2⁻).
* Ηλεκτροστατική έλξη: Τα αντίθετα φορτισμένα ιόντα στη συνέχεια προσελκύουν ο ένας τον άλλον μέσω ηλεκτροστατικών δυνάμεων, σχηματίζοντας έναν ιοντικό δεσμό.
Η προκύπτουσα ένωση, οξείδιο του αργιλίου (al₂o₃), είναι ένα στερεό με ένα υψηλό σημείο τήξης, ενδεικτικό των ισχυρών ιοντικών δεσμών που υπάρχουν.