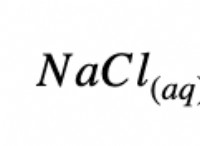Τι είδους ομοιοπολικό δεσμό είναι το NH3;
* Ηλεκτροργατιστικότητα: Το άζωτο (Ν) είναι πιο ηλεκτροαρνητικό από το υδρογόνο (Η). Αυτό σημαίνει ότι το άζωτο προσελκύει πιο έντονα τα κοινά ηλεκτρόνια στους δεσμούς.
* Μη εξής κοινή χρήση: Η άνιση κατανομή των ηλεκτρονίων δημιουργεί ένα μερικό αρνητικό φορτίο (δ-) στο άτομο αζώτου και μερικές θετικές χρεώσεις (Δ+) στα άτομα υδρογόνου.
* πολικό μόριο: Η ανομοιογενής κατανομή του φορτίου καθιστά την αμμωνία ένα πολικό μόριο, που σημαίνει ότι έχει θετικό και αρνητικό τέλος.
Συνοπτικά: Η διαφορά στην ηλεκτροαρνητικότητα μεταξύ αζώτου και υδρογόνου οδηγεί σε πολικούς ομοιοπολικούς δεσμούς στο NH3.