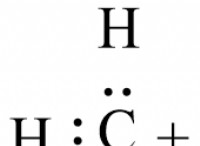Γιατί οι μεταλλικές ουσίες δεν μπορούν να διαλυθούν είτε σε πολικούς είτε σε μη διαλύτες;
Γιατί τα μέταλλα δεν διαλύονται εύκολα:
* Ισχυρή μεταλλική σύνδεση: Τα μέταλλα έχουν ισχυρούς μεταλλικούς δεσμούς όπου τα ηλεκτρόνια απομακρύνονται σε ένα πλέγμα θετικών ιόντων. Αυτοί οι δεσμοί είναι πολύ δύσκολο να σπάσουν από τις σχετικά αδύναμες δυνάμεις που υπάρχουν στους διαλύτες.
* Η διαλυτότητα απαιτεί αλληλεπίδραση: Για να διαλυθεί, μια διαλυμένη ουσία πρέπει να αλληλεπιδράσει ευνοϊκά με τα μόρια του διαλύτη. Τα μεταλλικά ιόντα τείνουν να έχουν υψηλές πυκνότητες φορτίου και να σχηματίζουν ισχυρές ηλεκτροστατικές αλληλεπιδράσεις με άλλα ιόντα και όχι με μόρια διαλύτη.
Εξαιρέσεις και αποχρώσεις:
* ΑΜΑΓΜΑΤΑ: Μέταλλα όπως το νάτριο και το κάλιο διαλύονται σε υγρό υδράργυρο για να σχηματίσουν αμαλγάματα. Αυτό οφείλεται στη μοναδική φύση του υδραργύρου, η οποία σχηματίζει αδύναμους δεσμούς με άλλα μέταλλα.
* μεταλλικά σύμπλοκα: Ορισμένα μέταλλα μπορούν να σχηματίσουν διαλυτά σύμπλοκα με ορισμένους συνδέτες σε συγκεκριμένους διαλύτες. Για παράδειγμα, ο χρυσός μπορεί να διαλυθεί στο Aqua Regia, ένα μείγμα νιτρικού οξέος και υδροχλωρικού οξέος, λόγω του σχηματισμού ανιόντων τετραχλωροαυροαξαλικού (III).
* σχηματισμός κράματος: Τα μέταλλα μπορούν να σχηματίσουν κράματα διαλύοντας σε τετηγμένα μέταλλα. Για παράδειγμα, ο Brass είναι ένα κράμα χαλκού και ψευδαργύρου.
* Ηλεκτροχημεία: Σε ηλεκτροχημικές διεργασίες, τα μέταλλα μπορούν να διαλύονται σε επιφάνεια ηλεκτροδίου λόγω αντιδράσεων μείωσης οξείδωσης. Αυτό δεν είναι αυστηρά "διάλυση" σε έναν διαλύτη, αλλά περιλαμβάνει χημικό μετασχηματισμό.
Είναι σημαντικό να θυμάστε:
* Η διαλυτότητα είναι ένα σύνθετο φαινόμενο: Εξαρτάται από το συγκεκριμένο μέταλλο, τον διαλύτη, τη θερμοκρασία και άλλους παράγοντες.
* "Διάλυση" μπορεί να έχει διαφορετικές έννοιες: Ενώ τα μέταλλα δεν διαλύονται σε παραδοσιακούς διαλύτες με την έννοια του σχηματισμού ενός ομοιογενούς μείγματος, μπορούν να υποβληθούν σε άλλους τύπους αλληλεπιδράσεων.
Επομένως, ενώ η γενική δήλωση σχετικά με τις μεταλλικές ουσίες που δεν διαλύονται είναι ακριβής, υπάρχουν σημαντικές εξαιρέσεις και αποχρώσεις που αποδεικνύουν την πολυπλοκότητα της διαλυτότητας.