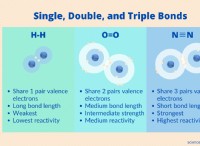
Τι σημαίνει αν ένα μόριο έχει πολλαπλούς ομοιοπολικούς δεσμούς;
Ιδιότητες:
* Υψηλότερη ενέργεια δεσμού: Οι πολλαπλοί ομοιοπολικοί δεσμοί είναι ισχυρότεροι και απαιτούν περισσότερη ενέργεια για να σπάσουν από τους μεμονωμένους ομοιοπολικούς δεσμούς. Αυτό έχει ως αποτέλεσμα μόρια με υψηλότερα σημεία τήξης και βρασμού.
* βραχύτερο μήκος δεσμού: Η κοινή χρήση πολλαπλών ζεύγους ηλεκτρονίων τραβά τα άτομα πιο κοντά, με αποτέλεσμα μικρότερο μήκος δεσμού.
* Αυξημένη σταθερότητα: Πολλαπλοί δεσμοί συμβάλλουν στη μεγαλύτερη συνολική σταθερότητα του μορίου.
Παραδείγματα:
* αιθένιο (C2H4): Κάθε άτομο άνθρακα στο αιθένιο μοιράζεται δύο ζεύγη ηλεκτρονίων με το άλλο άτομο άνθρακα, σχηματίζοντας διπλό δεσμό.
* Ethyne (C2H2): Κάθε άτομο άνθρακα στο Athyne μοιράζεται τρία ζεύγη ηλεκτρονίων με το άλλο άτομο άνθρακα, σχηματίζοντας τριπλό δεσμό.
* διοξείδιο του άνθρακα (CO2): Ο άνθρακας σχηματίζει διπλό δεσμό με κάθε άτομο οξυγόνου.
Συνέπειες:
* Αντιδραστικότητα: Τα μόρια με πολλαπλούς δεσμούς είναι συχνά πιο δραστικά από τα μόρια με μεμονωμένους δεσμούς, καθώς τα ηλεκτρόνια που εμπλέκονται στον πολλαπλό δεσμό είναι πιο εύκολα διαθέσιμα για αντιδράσεις.
* Γεωμετρία: Η παρουσία πολλαπλών δεσμών μπορεί να επηρεάσει το σχήμα του μορίου. Για παράδειγμα, ένα μόριο με διπλό δεσμό θα έχει επίπεδη γεωμετρία, ενώ ένα μόριο με τριπλό δεσμό θα έχει γραμμική γεωμετρία.
* Βιολογικές λειτουργίες: Οι πολλαπλοί δεσμοί είναι κρίσιμοι για τη δομή και τη λειτουργία πολλών βιολογικών μορίων, συμπεριλαμβανομένων των πρωτεϊνών, του DNA και των υδατανθράκων.
Συνοπτικά, πολλοί ομοιοπολικοί δεσμοί αποτελούν σημαντικό χαρακτηριστικό πολλών μορίων που συμβάλλουν στις μοναδικές ιδιότητες, την αντιδραστικότητα και τις βιολογικές λειτουργίες τους.