Γιατί το υδρογόνο είναι ξεχωριστό από το υπόλοιπο 1Α;
* Ηλεκτρονική διαμόρφωση: Το υδρογόνο έχει μόνο ένα ηλεκτρόνιο στο εξωτερικό κέλυφος του (1S1), όπως τα αλκαλικά μέταλλα. Ωστόσο, έχει μόνο ένα πρωτόνιο και ένα ηλεκτρόνιο, καθιστώντας το ένα πολύ μικρό άτομο. Αυτό το μικρό μέγεθος και η απλή δομή του δίνουν μοναδικές χημικές συμπεριφορές.
* Μη μεταλλική φύση: Σε αντίθεση με τα αλκαλικά μέταλλα, το υδρογόνο είναι μη μέταλλο. Είναι ένα αέριο σε θερμοκρασία δωματίου, ενώ τα αλκαλικά μέταλλα είναι όλα στερεά. Το υδρογόνο δεν διαθέτει επίσης τη μεταλλική λάμψη και την αγωγιμότητα που χαρακτηρίζει τα αλκαλικά μέταλλα.
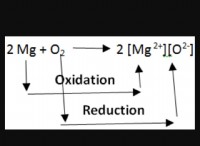
* Αντιδραστικότητα: Ενώ τα αλκαλικά μέταλλα είναι εξαιρετικά αντιδραστικά και χάνουν εύκολα το εξώτατο ηλεκτρόνιο τους για να σχηματίσουν κατιόντα, η αντιδραστικότητα του υδρογόνου είναι πιο λεπτή. Μπορεί να λειτουργήσει τόσο ως οξειδωτής όσο και ως μειωτής, ανάλογα με την κατάσταση. Μπορεί να χάσει το ηλεκτρόνιο του για να σχηματίσει ένα πρωτόνιο (Η+) ή να κερδίσει ένα ηλεκτρόνιο για να σχηματίσει ένα ιόν υδριδίου (Η-).
* καταστάσεις οξείδωσης: Το υδρογόνο μπορεί να έχει θετικές (+1) και αρνητικές (-1) καταστάσεις οξείδωσης, ενώ τα αλκαλικά μέταλλα έχουν μόνο θετικές (+1) καταστάσεις οξείδωσης.
Γιατί το υδρογόνο τοποθετείται μερικές φορές πάνω από την ομάδα 1;
Το υδρογόνο τοποθετείται μερικές φορές πάνω από την ομάδα 1 επειδή έχει ένα μόνο ηλεκτρόνιο σθένους, παρόμοιο με τα αλκαλικά μέταλλα. Ωστόσο, αυτή η τοποθέτηση είναι αμφιλεγόμενη. Κάποιοι υποστηρίζουν ότι είναι πιο κατάλληλο να το τοποθετήσουμε πάνω από την ομάδα 17 (αλογόνα) λόγω της ικανότητάς του να κερδίζει ένα ηλεκτρόνιο για να σχηματίσει το ιόν υδριδίου.
Συνοπτικά:
Τα μοναδικά χαρακτηριστικά του υδρογόνου, όπως το μικρό του μέγεθος, η μη μεταλλική φύση και η ευέλικτη αντιδραστικότητα, το διακρίνουν από τα αλκαλικά μέταλλα. Αυτός είναι ο λόγος για τον οποίο συνήθως διαχωρίζεται από την ομάδα 1 στον περιοδικό πίνακα, παρόλο που μοιράζεται κάποιες ομοιότητες με την ομάδα.